题目内容
A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构.下列说法中正确的是( )
| A、原子序数:B>A>C |
| B、原子半径:A>B>C |
| C、离子半径:A2->C->B2+ |
| D、原子最外层电子数:A>C>B |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:A、B、C为三种短周期元素,结合离子所带电荷可知,A是第ⅥA族,B是第ⅡA族,C位于第ⅦA,B2+与C-具有相同的电子层结构,则B位于C的下一周期,由于A、B同周期,则A、B处于第三周期,C处于第二周期,则A为S、B为Mg、C为F,周期自左向右,原子半径逐渐减小,同主族自上而下原子半径逐渐增大,而电子层结构相同核电荷数越大离子半径越小,据此解答.
解答:
解:A、B、C为三中短周期元素,结合离子所带电荷可知,A是第ⅥA族,B是第ⅡA族,C位于第ⅦA,B2+与C-具有相同的电子层结构,则B位于C的下一周期,由于A、B同周期,则A、B处于第三周期,C处于第二周期,则A为S、B为Mg、C为F,
A.A为S、B为Mg、C为F,原子序数:S>Mg>F,故A错误;
B.同周期自左向右,原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径是:Mg>S>F,故B错误;
C.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->F->Mg2+,故C正确;
D.A为S、B为Mg、C为F,原子核外最外层电子数:F>S>Mg,故D错误,
故选:C.
A.A为S、B为Mg、C为F,原子序数:S>Mg>F,故A错误;
B.同周期自左向右,原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径是:Mg>S>F,故B错误;
C.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->F->Mg2+,故C正确;
D.A为S、B为Mg、C为F,原子核外最外层电子数:F>S>Mg,故D错误,
故选:C.
点评:本题以周期表中元素的推断为载体,考查学生对元素周期表的熟悉程度、微粒半径比较等,是高考中的常见题型,中等难度.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
已知M2O7x-+3S2-+14H+=2M3++3S↓+yH2O,则M2O7x-中的M的化合价为( )
| A、+6 | B、+4 | C、+3 | D、+2 |
下列电离方程式书写正确的是( )
| A、BaSO4?Ba2++SO42- |
| B、H3PO4?3H++PO43- |
| C、Al(OH)3?H++AlO2-+H2O |
| D、NaHS=Na++H++S2- |
随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是( )
| A、无水硫酸铜、蔗糖 |
| B、生石灰、食盐 |
| C、生石灰、硫酸亚铁 |
| D、食盐、硫酸亚铁 |
下列事实不能说明有机物分子中原子或原子团直接相连时而产生相互影响的是( )
| A、苯酚能与NaOH溶液反应,而乙醇不行 |
| B、甲苯能使酸性高锰酸钾溶液褪色而甲烷不能 |
| C、苯与液溴在铁作催化剂下发生反应,而苯酚与浓溴水混合就能发生反应 |
| D、乙烯可发生加成反应,而乙烷不能 |
据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上氦元素主要以42He形式存在,下列说法中正确的是( )
| A、42He原子核内含有 4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、42He的最外层电子数为2,所以He很容易失去电子,具有较强的金属性 |
已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是( )
| A、2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
| B、I2+SO2+2H2O═H2SO4+2HI |
| C、H2O2+H2SO4═SO2↑+O2↑+2H2O |
| D、2Fe3++2I-═2Fe2++I2 |
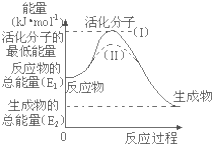 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图1,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图1,然后回答问题.