题目内容
7.镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得.该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2═17MgH2+12Al.得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气.(1)熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是防止Mg Al被空气氧化.
(2)在6.0mol•L-1HCl溶液中,混合物Y 能完全释放出H2.1molMg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为52mol.
(3)若要除去镁粉中的铝粉宜选用NaOH溶液,发生反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 (1)镁、铝是亲氧元素,易被氧气氧化;
(2)释放出的H2 包括Mg17Al12吸收的氢,还包括镁、铝和盐酸反应生成的氢气;
(3)Al与NaOH溶液反应,而Mg与NaOH溶液不反应,溶解后过滤可实现除杂,以此来解答.
解答 解:(1)Mg、Al都是活泼的金属单质,容易被空气中的氧气氧化,通入氩气作保护气,以防止二者被氧化,
故答案为:防止Mg Al被空气氧化;
(2)1molMg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,生成氢气的物质的量分别为17mol、12×$\frac{3}{2}$=18mol,则生成氢气一共(17+17+18)mol=52mol,
故答案为:52mol;
(3)Al与NaOH溶液反应,而Mg与NaOH溶液不反应,溶解后过滤可实现除杂,则除去镁粉中的少量铝粉,选用的试剂是NaOH溶液,发生的离子反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:NaOH溶液;2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查了物质分离与提纯、化学方程式计算,题目难度中等,明确发生反应实质为解答关键,注意掌握铝、镁及其化合物性质,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
18.某无色透明溶液中可能含有下列离子:Na+、NH4+、Fe2+、Mg2+、SO42-、HCO3-、CO32-、Cl-.对其进行如下实验:
①取少量溶液加入过量的Ba(OH)2溶液并加热,生成4.30g白色沉淀和0.51g刺激性气味气体放出;
②取①中上层清液,先加硝酸,再加入一定量的硝酸银溶液,生成1.435g沉淀;
③取①中固体加入过量的盐酸,沉淀剩余2.33g
下列关于该溶液的说法中一定正确的是( )
①取少量溶液加入过量的Ba(OH)2溶液并加热,生成4.30g白色沉淀和0.51g刺激性气味气体放出;
②取①中上层清液,先加硝酸,再加入一定量的硝酸银溶液,生成1.435g沉淀;
③取①中固体加入过量的盐酸,沉淀剩余2.33g
下列关于该溶液的说法中一定正确的是( )
| A. | 该溶液中一定含有SO42-、NH4+、CO32-、Cl-等离子 | |
| B. | 该溶液中至少含有0.23g Na+ | |
| C. | 该溶液中可能含有Mg2+和Cl- | |
| D. | 该溶液中含有0.355g Cl- |
15.有关电化学知识的描述正确的是( )
| A. | CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 | |
| B. | 其他条件均相同,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长 | |
| C. | 原电池工作时,正极表面一定有气泡产生 | |
| D. | 钢铁水闸可用牺牲阴极或外加电流的阳极保护法防止其腐蚀 |
19.除去下列物质中的杂质(括号内是杂质),能采用加入过量NaOH溶液再过滤的是( )
| A. | SiO2(CaCO3) | B. | KCl(NaCl) | C. | Fe2O3(Al2O3) | D. | FeCl2溶液(FeCl3) |
11.无色透明溶液中能大量共存的离子组是( )
| A. | K+、Al3+、HCO3-、NO3- | B. | AlO2-、Cl-、Mg2+、K+ | ||
| C. | NH4+、Na+、CH3COO-、NO3- | D. | Na+、NO3-、ClO-、I- |
 的名称为2,3-二乙基-1-戊烯.
的名称为2,3-二乙基-1-戊烯.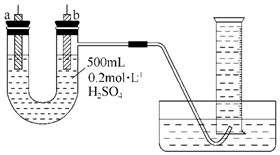 给你提供纯锌、纯铜片和500mL 0.2mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.
给你提供纯锌、纯铜片和500mL 0.2mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.