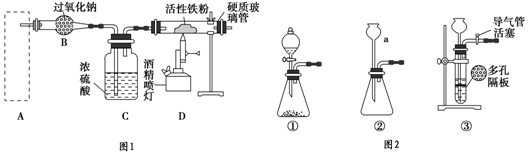
题目内容
5.在测定硫酸铜晶体结晶水含量的试验中,以下操作会使测定结果偏高的是( )| A. | 晶体中含有受热不分解的杂质 | |
| B. | 加热过程中有少量晶体爆溅损失 | |
| C. | 加热后未放入干燥器中冷却 | |
| D. | 加热时未进行搅拌,看到固体边缘变白就停止加热 |
分析 在硫酸铜晶体(CuSO4•n H2O)结晶水含量测定中,加热前后质量的减少量即是失去结晶水的质量,当晶体中含有受热不分解的杂质、加热后未放入干燥器中冷却、加热时未进行搅拌,看到固体边缘变白就停止加热等都会导致n偏小;加热过程中有少量晶体爆溅损失时,测定的结晶水的质量偏高,测定结果偏高,据此进行解答.
解答 解:A.晶体中含有受热不分解的杂质,导致测定的结晶水质量偏低,测定的n偏小,故A错误;
B.加热过程中晶体爆溅,而造成加热前后固体的质量差偏大,使测量结果偏高,故B正确;
C.加热后未放入干燥器中冷却,导致测定的结晶水质量偏低,测定的n偏小,故C错误;
D.加热时未进行搅拌,看到固体边缘变白就停止加热,晶体未完全变白,导致晶体分解不完全,固体的质量差偏小,使测量结果偏小,故D错误;
故选B.
点评 本题考查硫酸铜晶体中结晶水的测定,题目难度不大,把握实验操作时的注意事项,分析误差时从导致加热前后的质量差进行判断,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
15.下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①在敞口容器中将金属钠投入到FeC12溶液中
②向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液
③向硅酸钠溶液中逐滴加入过量的盐酸
④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入过量CO2.
①在敞口容器中将金属钠投入到FeC12溶液中
②向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液
③向硅酸钠溶液中逐滴加入过量的盐酸
④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入过量CO2.
| A. | ①③④⑤ | B. | 只有①④ | C. | 只有②③ | D. | 只有③④⑤ |
16.我国古代有“银针验毒”的记载.“银针验毒”的反应原理之一是4Ag+2H2S+O2=2X+2H2O.下列有关该反应的说法正确的是( )
| A. | Ag得到电子 | B. | X为AgS | ||
| C. | O2被还原 | D. | 每生成1 mo1X转移电子数4NA |
7.下列各组离子可能大量共存的是( )
| A. | 常温下,c(H+)=1×10-12mol•L-1的溶液中:A13+、Fe3+、SO42-、Cl- | |
| B. | pH=0的溶液中:Fe2+、Ba2+、NO3-、Cl- | |
| C. | 常温下,水电离的c(H+)为1×10-12mol•L-1的溶液中:Na+、NH4+、HCO3-、NO3- | |
| D. | 能使酚酞试液变红色的溶液中:Na+、K+、SiO32-、S2O32- |
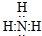 ,氯化铵
,氯化铵 .
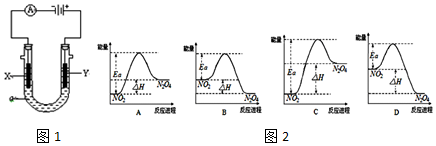
.
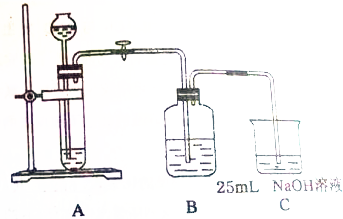 某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤:
某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤: