题目内容
(1)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是
(2)下列盐溶液能发生水解的用离子方程式表示,不能发生水解的写“不发生水解”字样,并说明溶液的酸碱性
K2CO3 溶液呈 性;
Na2SO4 溶液呈 性;
CuCl2 溶液呈 性.
(2)下列盐溶液能发生水解的用离子方程式表示,不能发生水解的写“不发生水解”字样,并说明溶液的酸碱性
K2CO3
Na2SO4
CuCl2
考点:盐类水解的应用
专题:盐类的水解专题
分析:(1)先判断是否水解及水解产物,再根据水解产物判断灼烧时的分解产物.
(2)先判断是否有弱离子再确定是否水解,结合水解方程式判断溶液的酸碱性.
(2)先判断是否有弱离子再确定是否水解,结合水解方程式判断溶液的酸碱性.
解答:
解:(1)AlCl3是强酸弱碱盐,能水解生成氢氧化铝和氯化氢,AlCl3+3H2O
Al(OH)3+3HCl,HCl具有挥发性,所以在加热蒸发、蒸干,灼烧过程中挥发消失;灼烧Al(OH)3,Al(OH)3能分解生成氧化铝和水2Al(OH)3
Al2O3+3H2O,水在加热过程中蒸发掉,所以最后得到的白色固体是Al2O3,
故答案为:Al2O3;
(2)K2CO3是强碱弱酸盐,水解后水溶液都呈碱性,水解离子方程式为 CO32-+H2O?HCO3-+OH-;
Na2SO4是强酸强碱盐,不水解,溶液呈中性;
CuCl2是强酸弱碱盐,水解后溶液呈酸性,水解离子方程式为:Cu2++2H2O?Cu(OH)2+2H+;
故答案为:CO32-+H2O?HCO3-+OH-,碱; 不发生水解,中性; Cu2++2H2O?Cu(OH)2+2H+,酸.
| 水解 |
| ||
故答案为:Al2O3;
(2)K2CO3是强碱弱酸盐,水解后水溶液都呈碱性,水解离子方程式为 CO32-+H2O?HCO3-+OH-;
Na2SO4是强酸强碱盐,不水解,溶液呈中性;
CuCl2是强酸弱碱盐,水解后溶液呈酸性,水解离子方程式为:Cu2++2H2O?Cu(OH)2+2H+;
故答案为:CO32-+H2O?HCO3-+OH-,碱; 不发生水解,中性; Cu2++2H2O?Cu(OH)2+2H+,酸.
点评:1、盐类水解规律:有弱(弱离子)才水解,无弱(弱离子)不水解,谁弱(弱离子)谁水解,谁强显谁性(酸碱性).

练习册系列答案
相关题目
有关物质用途的说法正确的是( )
| A、二氧化硅可用作半导体材料 |
| B、明矾可用于水的杀菌消毒 |
| C、碳酸氢钠可用于治疗胃酸过多 |
| D、硅可用于制造光导纤维 |
酸根RO3-所含电子数比硝酸根NO3-的电子数多10.则下列说法正确的是( )
| A、R原子的电子层数比N的电子层数多1 |
| B、R元素的最高正化合价与NO3-中的N的化合价相等 |
| C、RO3-和NO3-都只能被还原,不能被氧化 |
| D、R和N为同族元素 |
某无色溶液中可能含有I-、K+、Cu2+、SO32-(还原性:SO32->I-),向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是( )
①肯定不含I-; ②肯定不含Cu2+; ③肯定含有SO32-; ④可能含有I-.
①肯定不含I-; ②肯定不含Cu2+; ③肯定含有SO32-; ④可能含有I-.
| A、①③ | B、①②③ |
| C、②③④ | D、①② |
微粒有多种表示方式,下列各组不同表示方式一定代表同种微粒的是( )
| A、C3H6、CH2=CHCH3 |
B、-OH、 |
C、 、 、 |
D、 、1s22s22p63s23p6 、1s22s22p63s23p6 |
下列溶液中H+的物质的量浓度最大的是( )
| A、0.1mol/L的硫酸 |
| B、0.1mol/L的碳酸 |
| C、0.1mol/L的醋酸 |
| D、0.1mol/L的盐酸 |
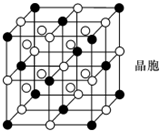 A,B,C,D,E,F都是短周期元素,原子序数依次增大,B,C同周期且相邻,A,D同主
A,B,C,D,E,F都是短周期元素,原子序数依次增大,B,C同周期且相邻,A,D同主 表示)位于该正方体的顶点和面心.该化合物的化学式是
表示)位于该正方体的顶点和面心.该化合物的化学式是
 )也是一种重要的香料,主要用于食品、化妆品等工业中.请设计合理方案,以对异丙基苯甲醛(
)也是一种重要的香料,主要用于食品、化妆品等工业中.请设计合理方案,以对异丙基苯甲醛( )和丙醛为原料合成兔耳草醛(用合成路线流程图表示,并注明反应条件).
)和丙醛为原料合成兔耳草醛(用合成路线流程图表示,并注明反应条件).