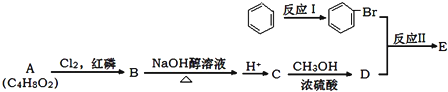
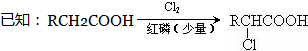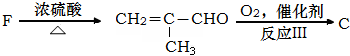题目内容
pH=13的强碱溶液与pH=2的强酸混合,已知所得混合溶液的pH=11,求混合前强碱与强酸溶液的体积比.
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:pH=13的强碱溶液中c(OH-)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,混合液的pH=11,则混合溶液中c(OH-)=10-3mol/L=
,据此计算酸碱体积之比.
| c(OH-)V碱-c(H+)V酸 |
| V碱+V酸 |
解答:
解:pH=13的强碱溶液中c(OH-)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,混合液的pH=11,
则混合溶液中c(OH-)=10-3mol/L=
=
,
解得:V(碱):V(酸)=1:9,
答:强碱溶液与强酸溶液的体积比为1:9.
则混合溶液中c(OH-)=10-3mol/L=
| c(OH-)V碱-c(H+)V酸 |
| V碱+V酸 |
| 0.1×V碱-0.01×V酸 |
| V碱+V酸 |
解得:V(碱):V(酸)=1:9,
答:强碱溶液与强酸溶液的体积比为1:9.
点评:本题考查了pH的简单计算,题目难度不大,试题侧重基础知识的考查,根据混合溶液中氢氧根离子浓度计算公式进行计算即可,注意溶液酸碱性与溶液pH的关系.

练习册系列答案
相关题目
二氧化碳通入下列溶液中,不可能产生沉淀的是( )
| A、氯化钙溶液 | B、石灰水 |
| C、偏铝酸钠 | D、硅酸钠溶液 |
下列叙述正确的是( )
| A、液氨可用作致冷剂 |
| B、向Fe( OH ) 3 胶体中滴入过量的NaHSO4溶液,能使胶体发生凝聚而沉淀 |
| C、熔融状态下能够导电的化合物中一定存在离子键 |
| D、28g 乙烯和氮气的混合气体中含有NA个原子(戈代表阿伏加德罗常数的值) |
根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是( )
①Cl2+2KI══I2+2KCl
②2FeCl3+2HI══I2+2FeCl2+2HCl
③2FeCl2+Cl2══2FeCl3
④I2+SO2+2H2O══2HI+H2SO4.
①Cl2+2KI══I2+2KCl
②2FeCl3+2HI══I2+2FeCl2+2HCl
③2FeCl2+Cl2══2FeCl3
④I2+SO2+2H2O══2HI+H2SO4.
| A、Cl2>I2>Fe3+>SO2 |
| B、Cl2>Fe3++>I2>SO2 |
| C、Fe3+>Cl2>I2>SO2 |
| D、Cl2>Fe3+>SO2>I2 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、16g氧气和臭氧的混合物中含有NA个氧原子,该混合物的体积一定小于11.2 L |
| B、1 L 0.2 mol/L的CH3COOH溶液中,H+数目为0.2NA |
| C、5.6g铁与足量氯气或硫蒸气反应转移的电子数为0.3NA |
| D、在常温常压下,等质量的H2和O2的体积之比是16:1 |
 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景. (X为卤原子,R为取代基)
(X为卤原子,R为取代基)