题目内容
用含FeS2质量分数为80%的硫铁矿制硫酸,相关反应方程式为:4Fe2S+11O2
2Fe2O3+8SO2,2SO2+O2
2SO3,SO3+H2O→H2SO4.若煅烧时损伤6%的硫元素,由SO2制SO3的转化率为98%.则制取1t98%的硫酸需要多少吨这种硫铁矿?
| 高温 |
| V2O5 |
| △ |
考点:化学方程式的有关计算
专题:
分析:用含FeS2质量分数为80%的硫铁矿制硫酸,转化过程为FeS2~2SO2~2SO3~2H2SO4,依据硫原子个数守恒找到FeS2与H2SO4的关系进行计算.
解答:
解:用含FeS2质量分数为80%的硫铁矿制硫酸,转化过程为FeS2~2SO2~2SO3~2H2SO4,设制取1t98%的硫酸需要铁矿石为xt则:
FeS2 ~2SO2 ~2SO3 ~2H2SO4,
120g 196g
x×80%×94%×98% 1t×98%
120:196=x×80%×94%×98%:1t×98% 解得:x=0.814t;
答:制取1t98%的硫酸需要0.814吨这种硫铁矿.
FeS2 ~2SO2 ~2SO3 ~2H2SO4,
120g 196g
x×80%×94%×98% 1t×98%
120:196=x×80%×94%×98%:1t×98% 解得:x=0.814t;
答:制取1t98%的硫酸需要0.814吨这种硫铁矿.
点评:本题考查化学方程式的计算,能够依据原子个数守恒找出硫化亚铁与硫酸之间的关系是解题关键,题目难度中等.

练习册系列答案
相关题目
下列物质中,属于纯净物的是( )
①陶瓷,②水泥,③玻璃,④漂白粉,⑤胆矾,⑥氯水,⑦液氯.
①陶瓷,②水泥,③玻璃,④漂白粉,⑤胆矾,⑥氯水,⑦液氯.
| A、③⑦ | B、③④⑥ | C、⑤⑦ | D、⑥⑦ |
含铝物质的下列用途与其性质有对应关系的是( )
| A、金属铝有好的导热性,常用铝箔做包装材料 |
| B、Al2O3是两性氧化物,常用其作耐火材料 |
| C、Al(OH)3能与胃液中的盐酸反应,可用其制作中和胃酸的药物 |
| D、明矾能吸附水中的悬浮物,可用其作净水剂 |
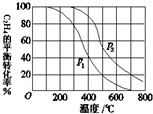 (1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产.
(1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产.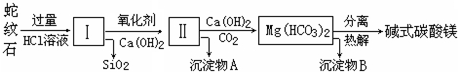
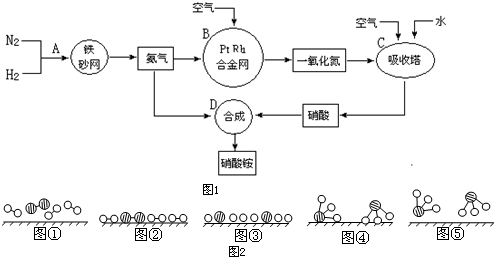
 分别表示N2、H2、NH3.
分别表示N2、H2、NH3. 纯净物根据其组成和性质可进行如图所示分类
纯净物根据其组成和性质可进行如图所示分类