题目内容
3.某溶液中含有大量的 K+、Cl-及 X与 Y两种离子,现向该溶液加入 W试剂,根据实验现象得到的关于X、Y离子的推断能成立的是( )
| W试剂 | 实验现象 | X、Y离子的推测 | |
| A | KI-淀粉溶液 | 溶液变蓝 | Fe3+、SO42- |
| B | 用pH试纸检测 | pH=7(常温) | CH3COO-、Na+ |
| C | 硝酸酸化的AgNO3溶液 | 白色沉淀 | CO32-、NH4+ |
| D | 过量NaOH溶液 | 无明显现象 | Al3+、Mg2+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A、Fe3+能够氧化碘离子使KI-淀粉溶液变蓝;
B、醋酸根离子水解,导致溶液显碱性;
C、AgCl是不溶于硝酸的白色沉淀;
D、氢氧化镁是白色沉淀.
解答 解:A、Fe3+能够氧化碘离子使KI-淀粉溶液变蓝,且与K+、Cl-、SO42-能够共存,故A正确;
B、K+、Cl-、Na+能够共存且不水解,醋酸根离子水解,导致溶液显碱性,pH不可能等于7,故B错误;
C、原溶液中含有K+、Cl-离子,加入硝酸银能够生成白色沉淀,不能确定是否含有其他离子,故C错误;
D、加入NaOH无明显现象,说明原溶液中没有镁离子,故D错误;
故选A.
点评 本题主要考查的是离子共存、离子检验问题,涉及盐类水解、氧化还原反应,难度不大.

练习册系列答案
相关题目
13.许多国家重视海水资源的综合利用,不需要化学变化就能够从海水中获得的物质是( )
| A. | 氯、溴、碘 | B. | 烧碱、氢气 | C. | 粗盐、淡水 | D. | 钠、镁、铝 |
14.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4 L氩气约含2 NA个氩原子 | |
| B. | 14 g乙烯和丙烯混合气体中含有2 NA个氢原子 | |
| C. | 标准状况下,2.24 L CCl4含有0.4 NA根共价键 | |
| D. | 1 mol N2与3 mol H2充分反应,生成2 NA个NH3分子 |
11.元素周期表中铊的数据如图,下列说法正确的是( )


| A. | 铊元素的质量数是204.4 | B. | 铊原子的中子数为81 | ||
| C. | 铊对应的氢氧化物有两性 | D. | 铊元素位于第ⅢA族 |
18.检验苯甲醛中是否含有苯甲醇可用的试剂是( )
| A. | 金属钠 | B. | 银氨溶液 | C. | 新制氢氧化铜 | D. | 饱和食盐水 |
15.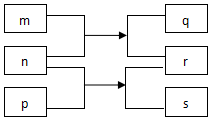 短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 离子半径大小:Y>Z>W | |
| B. | 简单气态氢化物的稳定性:R>Y | |
| C. | W的最高价氧化物对应的水化物碱性比Z的强 | |
| D. | 单质熔点:Z>R>X |
12.下列物质中所含的杂质(括号中是杂质),使用NaOH溶液不能除去的是( )
| A. | MgO固体(Al2O3) | B. | Na2CO3溶液(NaHCO3) | ||
| C. | MgCl2溶液(AlCl3) | D. | 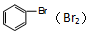 |
12.下列气体不会造成大气污染的是( )
| A. | N2 | B. | SO2 | C. | CO | D. | NO2 |
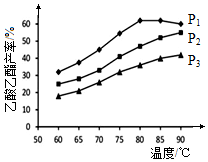 醋酸由于成本较低,在生产中被广泛应用.
醋酸由于成本较低,在生产中被广泛应用.