题目内容
9. 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理其对环境的污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理其对环境的污染是当前环保工作的重要研究内容之一.(1)一定条件下,发生反应2SO2(g)+O2(g)?2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的物质的量为1mol,则该可逆反应的平衡常数K=5.76;恒温下,若往容器中再加入2mol SO2(g),则重新达到平衡时SO2的总转化率<50%(填“>”、“<”或“=”).
(2)在一密闭容器中发生反应2NO2?2NO+O2△H>0,反应过程中NO2的浓度随时间变化的情况如图所示.
请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为0.0117mol•L-1•min-1.
②若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件可能是温度(填“浓度”、“压强”、“温度”或“催化剂”).
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5(g)?4NO2(g)+O2(g)
②2NO2(g)?2NO(g)+O2(g)
若达平衡时,c(NO2)=0.4mol•L-1,c(O2)=1.3mol•L-1,则反应②中NO2的转化率为80%,N2O5(g)的起始浓度应不低于1mol•L-1.
分析 (1)依据化学平衡的三段式列式计算平衡浓度,结合平衡常数概念计算;依据化学平衡的影响因素和移动原理分析判断;
(2)①依曲线A,根据V=$\frac{△c}{△t}$计算反应在前3min内NO2的平均反应速率,再根据速率之比等于系数之比计算氧气的平均反应速率;
②由图象可知B状态反应较快,且A、B处于不同平衡状态,B状态NO2的物质的量较少,结合温度、压强对平衡移动的影响判断;
(3)设出反应①和反应②产生的氧气的浓度分别为Xmol•L-1,Y mol•L-1,然后依据方程组建立关系求解,得出反应②中NO2的转化率和N2O5(g)的起始浓度.
解答 解:(1)一定条件下,2SO2(g)+O2(g)?2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的物质的量为1mol,则
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 1 0.5 0.1
变化量(mol/L) 0.5 0.25 0.5
平衡量(mol/L) 0.5 0.25 0.6
平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$=$\frac{0.{6}^{2}}{0.{5}^{2}×0.25}$=5.76,
若往容器中再加入2mol SO2(g),平衡正向进行,由于三氧化硫浓度比起始大,则重新达到平衡时SO2的总转化率小于50%,
故答案为:5.76;<;
(2)①依曲线A,前3min内NO2的平均反应速率V=$\frac{△c}{△t}$=$\frac{0.20-0.13}{3}$mol/(L•min)=$\frac{0.07}{3}$mol/(L•min),又因为速率之比等于系数之比,所以氧气的平均反应速率为$\frac{0.07}{3}$×$\frac{1}{2}$mol/(L•min)=0.0117mol/(L•min),
故答案为:0.0117 mol•L-1•min-1;
②由图象可知B状态反应较快,且A、B处于不同平衡状态,肯定不是催化剂的影响,如是压强的影响,则增大压强,平衡向逆反应方向移动,则NO2的物质的量应增大,但B状态NO2的物质的量较少,应是升高温度的原因,该反应的正反应为吸热反应,升高温度平衡向正反应方向移动,则NO2的物质的量减少,
故答案为:温度;
(3)设出反应①和反应②产生的氧气的浓度分别为Xmol•L-1,Y mol•L-1,
2N2O5(g)?4NO2(g)+O2(g)①
2X 4Xmol•L-1 Xmol•L-1
2NO2(g)?2NO(g)+O2(g)②
2Ymol•L-1 Ymol•L-1
则建立关系:X+Y=1.3;4X-2Y=0.4;解得:X=0.5;Y=0.8;反应②中NO2的转化率为$\frac{1.6mol/L}{2mol/L}$×100%=80%,由①反应生成的O2的浓度为0.5 mol•L-1,知N2O5的起始浓度应大于1 mol•L-1,N2O5的起始浓度应不低于1mol•L-1,
故答案为:80%;1.
点评 本题主要考查了化学平衡的计算及其平衡移动的判断,涉及速率的计算等知识点,利用三行式计算是解题的关键,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 乙醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | 间二溴苯仅有一种空间结构的事实可证明苯分子中不存在单双键交替的结构 | |
| D. | (CH3)2C=CHCH2CH3分子中的6个碳原子中至少有5个在同一个平面上 |
 用图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )
用图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )| 选项 | 气体 | a | b | c | d |
| A | SO2 | 浓硫酸 | Cu | H2O | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和NH4Cl溶液 | 消石灰 | 空集气瓶 | 固体NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 葡萄糖、油脂、蛋白质都是由C、H、O三种元素组成的 | |
| B. | 油脂有油和脂肪之分,都属于酯 | |
| C. | 葡萄糖、果糖和蔗糖都能发生水解反应 | |
| D. | 糖类、油脂、蛋白质都是高分子化合物 |
| A. | 羟基、甲基电子数相同 | |
| B. | 所有烃基和苯基都不是官能团 | |
| C. | 甲醛和一氯甲烷在常温下呈气态,而溴乙烷、苯甲酸、饱和高级脂肪酸甘油酯在常温 下呈液态 | |
| D. | 不含羟基和羧基的有机物水溶性都较差 |
| A. | 若样品为水溶液且只取一次有机物,检验 中官能团,应该先向其中加入 三氯化铁溶液检验酚羟基;再加入足量氢氧化钠溶液,加热,用稀硝酸酸化后,最后加入 硝酸银溶液检验氯原子 中官能团,应该先向其中加入 三氯化铁溶液检验酚羟基;再加入足量氢氧化钠溶液,加热,用稀硝酸酸化后,最后加入 硝酸银溶液检验氯原子 | |
| B. | 只检验 CH2=CH-CHO 中的碳碳双键不能用溴水,但是可以用溴的四氯化碳溶液 | |
| C. | 若样品为水溶液且只取一次有机物,检验 ClCH2COOH 中官能团,应该先加入足量氢 氧化钠溶液,加热,再用足量稀硝酸酸化后,加入硝酸银溶液检验氯原子;最后加入碳酸 氢钠溶液检验羧基 | |
| D. | 若样品为水溶液且只取一次有机物,检验邻羟基苯甲醇中的官能团,应该先加入紫色 石蕊试液检验酚羟基;再加入金属钠检验醇羟基 |
| A. | 1mol氯气、水、碘(I2)在标准状况下所含分子数相等 | |
| B. | 在非标准状况下,1mol任何气体的体积不可能是22.4L | |
| C. | 同温同压下两种气体,只要它们的分子数相同,所占体积几乎相同 | |
| D. | 1mol气体的体积不一定是22.4L |
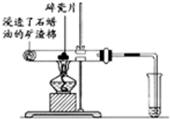 (1)写出下列反应的化学方程式:
(1)写出下列反应的化学方程式: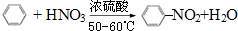 .
.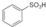 ),根据质量守恒定律,可判断出另一个反应产物为H2O.
),根据质量守恒定律,可判断出另一个反应产物为H2O.