题目内容
6.下列说法错误的是( )| A. | 1H和3H是不同的核素 | |
| B. | 1H、2H、3H、H+和H2是氢元素的五种不同粒子 | |
| C. | 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 | |
| D. | 石墨和金刚石互为同位素,化学性质相似 |
分析 A.核素指的是原子;
B.微粒指的是原子、分子和离子;
C.质子数决定元素的化学性;
D.同位素是质子数相同、中子数不同的原子.
解答 解:A.1H和3H质子数相同,质量数不同,属于不同的核素.故A正确;
B.11H、12H、13H是氢元素的三种不同粒子,H+表示氢离子,H2表示氢气分子,故B正确;
C.质子数决定元素的化学性,这两种原子质子数相同化学性质相同,故C正确;
D.石墨和金刚石是同种元素形成的不同种单质,互为同素异形体,不是同位素,故D错误,
故选D.
点评 本题主要考查的是同位素、同素异形体的概念,难度不大,注意区别这两个概念.

练习册系列答案
相关题目
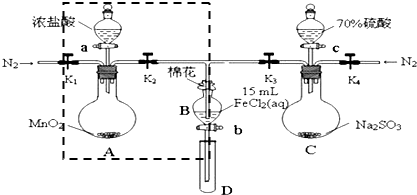
16.为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略).实验过程:
①检查装置气密性后,在各仪器中添加相应试剂.
②打开弹簧夹K1~K4,通入一段时间N2,将T型管插入B中,继续通入N2,然后关闭K1、K3、K4.
③打开活塞a,滴加一定量的浓盐酸,加热A.
④当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
⑤打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
⑥打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
⑦更换试管D,重复过程⑤,检验B溶液中的离子.
试回答下列问题:
(1)检验图中虚线框内装置气密性的具体操作是关闭K1、K2,打开分液漏斗的盖子和活塞,向其中加入水,一段时间后分液漏斗尖嘴处不再滴液即证明气密性良好.
(2)C中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为2MnO4-+5SO2+4H2O=2Mn2++5SO42-+4H+.
(4)B中的棉花通常会浸润NaOH溶液试剂;实验②中通入N2的作用是排除装置中的空气,防止FeCl2溶液被O2氧化.
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性 Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
(6)进行实验过程⑥时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色.
查阅资料:Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.某同学设计如下实验,证实该假设成立:

①溶液E和F分别为Na2SO3(或可溶性亚硫酸盐)、FeCl3.
②请结合方程式和化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因Fe3+与SO32-反应Fe3++SO32-=Fe2++SO42-,使c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色.
①检查装置气密性后,在各仪器中添加相应试剂.
②打开弹簧夹K1~K4,通入一段时间N2,将T型管插入B中,继续通入N2,然后关闭K1、K3、K4.
③打开活塞a,滴加一定量的浓盐酸,加热A.
④当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
⑤打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
⑥打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
⑦更换试管D,重复过程⑤,检验B溶液中的离子.

试回答下列问题:
(1)检验图中虚线框内装置气密性的具体操作是关闭K1、K2,打开分液漏斗的盖子和活塞,向其中加入水,一段时间后分液漏斗尖嘴处不再滴液即证明气密性良好.
(2)C中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为2MnO4-+5SO2+4H2O=2Mn2++5SO42-+4H+.
(4)B中的棉花通常会浸润NaOH溶液试剂;实验②中通入N2的作用是排除装置中的空气,防止FeCl2溶液被O2氧化.
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性 Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
| 过程⑤B溶液中含有的离子 | 过程⑦B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查阅资料:Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.某同学设计如下实验,证实该假设成立:

①溶液E和F分别为Na2SO3(或可溶性亚硫酸盐)、FeCl3.
②请结合方程式和化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因Fe3+与SO32-反应Fe3++SO32-=Fe2++SO42-,使c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色.
14.一定温度下,反应2NO+O2?2NO2在容积不变的密闭容器中进行,下列措施不改变化学反应速率的是( )
| A. | 升高反应温度 | B. | 保持容积不变,充入NO2 | ||
| C. | 保持容积不变,充入He | D. | 保持压强不变,充入He |
11.运用元素周期律分析下列推断,其中错误的是( )
| A. | 硫酸锶难溶于水 | |
| B. | 铍是一种轻金属,它的氧化物的水化物可能具有两性 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 砹单质是一种有色固体,砹化氢很不稳定用 |
18.相同温度下,下列物质中导电性最强的是( )
| A. | 80ml 0.1 mol•L-1NaCl溶液 | B. | 50ml 0.1 mol•L-1MgSO4溶液 | ||
| C. | 100ml 0.1 mol•L-1氨水 | D. | 0.1 mol固体氯化钠 |
15.在从海带中提取碘的实验中,下列做法错误的是( )
| A. | 装有干海带的坩埚置于泥三角上加热灼烧 | |
| B. | 加入过量的氯水确保I-被完全氧化 | |
| C. | 用四氯化碳溶液萃取碘单质,上层为水层可以弃去 | |
| D. | 可利用碘单质易升华的特性来提纯碘单质 |
16.用我们日常生活中的食用白醋(醋酸浓度约为1mol•L-1)进行下列实验,能证明醋酸为弱电解质的是( )
| A. | 白醋中滴入石蕊试液呈红色 | |
| B. | 白醋加入豆浆中有沉淀产生 | |
| C. | 经检验白醋中c(H+)约为0.01 mol•L-1 | |
| D. | 蛋壳浸泡在白醋中有气体放出 |
 .
. 、
、 .
.