题目内容
7.工业上可以用废铁屑制备活性Fe3O4,流程如图1: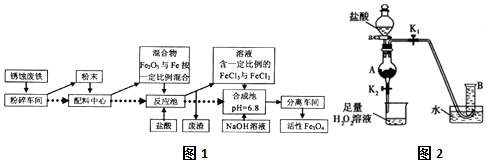
(1)在制备过程中,不但要将块状固体原料粉碎、磨成粉末,作用是增大反应物之间的接触面积,增加反应速率,提高生产效率.
(2)在合成池里生成Fe3O4的离子方程式为Fe2++2Fe3++8OH-=Fe3O4↓+4H2O.
(3)根据流程可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近4:1.
(4)某同学利用废铁屑(含Fe和Fe2O3)来制取FeCl3•6H2O晶体,同时测定混合物中铁的质量分数,装置如图2(夹持装置略,气密性已检验):
操作步骤如下:
I.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeC13•6H2O晶体.
请回答:
①操作Ⅱ中“…”的内容是当A中固体完全消失,烧杯中的现象是无色溶液逐渐变黄,有气泡产生,相应的方程式是2Fe2++H2O2+2H+=2Fe3++2H2O、2H2O2 $\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑_.(是离子反应的写离子方程式)
②若混合物质量为m g,实验结束后测得B中所得的气体是V mL(标准状况时),该同学由此计算出此废铁屑中铁的质量分数是$\frac{V}{400m}$,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少.
分析 (1)固体的表面积越大,反应速率越快;
(2)Fe2+与Fe3+在碱性条件下反应生成Fe3O4;
(3)没有气体产生,说明铁刚好使三价铁转化为二价铁,由于在1molFe3O4中可以认为有二价的氧化亚铁和三价的三氧化铁各1mol,设Fe为Xmol,Fe2O3为ymol,生成1molFe3O4,根据Fe+2Fe3+=3Fe2+解题;
(4)①装置A中的铁完全消失,反应结束;打开弹簧夹K2,反应生成的氯化亚铁被双氧水氧化成氯化铁,同时有氧气放出;根据氯化亚铁被双氧水氧化、生成的氯化铁作催化剂使双氧水分解情况,写成反应方程式;
②“用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体”,氧化铁溶于盐酸,生成的三价铁离子能够消耗铁;
解答 解:(1)固体的表面积越大,反应速率越快,所以在工业生产中,将块状固体磨成粉末,并在反应池中安装搅拌机,目的是增加反应速率,故答案为:增大反应物之间的接触面积,增加反应速率,提高生产效率;
(2)Fe2+与Fe3+在碱性条件下反应生成Fe3O4,反应的离子方程式为:Fe2++2Fe3++8OH-=Fe3O4↓+4H2O;故答案为:Fe2++2Fe3++8OH-=Fe3O4↓+4H2O;
(3)没有气体产生,说明铁刚好使三价铁转化为二价铁,由于在1molFe3O4中可以认为有二价的氧化亚铁和三价的三氧化铁各1mol,
设Fe为Xmol,Fe2O3为ymol,生成1molFe3O4,根据Fe+2Fe3+=3Fe2+则有:
X+2Y=3;3X=1
解得X=$\frac{1}{3}$;Y=$\frac{4}{3}$,故Fe2O3与Fe物质的量之比为4:1;
故答案为:4:1;
(4)①当A中固体完全消失,铁完全和盐酸反应后,反应结束;当A中溶液完全进入烧杯,生成的氯化亚铁被氧化成黄色的氯化铁,生成的氯化铁作催化剂,使双氧水分解,反应的方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,2H2O2 $\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑,
故答案是:当A中固体完全消失;无色溶液逐渐变黄,有气泡产生;2Fe2++H2O2+2H+=2Fe3++2H2O,2H2O2 $\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑;
②由于废铁屑中含有氧化铁,和盐酸反应生成的三价铁离子能够和铁反应,导致铁减少,置换的氢气体积减少,
故答案是:Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少.
点评 本题考查物质的分离、提纯和除杂以及铁屑中铁的质量分数和制取氯化铁晶体,涉及了较多的化学方程式的书写、质量分数的计算、实验操作等知识,难度中等,注意实验基本操作方法,把握实验原理.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案| A. | K、L、M、N | B. | s、p、d、f | C. | px、py、pz | D. | ↑、↓ |
| A. | v(D)=24mol•L-1•min-1 | B. | v(C)=0.5mol•L-1•s-1 | ||
| C. | v(B)=30mol•L-1•min-1 | D. | v(A)=0.15 mol•L-1•s-1 |
| A. | 在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子 | |
| B. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| C. | 标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| D. | NA个一氧化碳分子和0.5mol甲烷的质量比为7:2 |
①2A-+C2═2C-+A2
②2C-+B2═2B-+C2
则有关说法中不正确的是( )
| A. | 氧化性:B2>C2>A2 | |
| B. | 在含有C-和A-的溶液中加入B2,C-优先发生反应 | |
| C. | 还原性:A->C->B- | |
| D. | 在含有B2和C2的溶液中加入A-,B2优先发生反应 |
| A. | 1L水中含有1mol硫酸 | B. | 1L溶液中含有1molH+ | ||
| C. | 将98gH2SO4溶于1L水所配制的溶液 | D. | 指1L硫酸溶液中含有1molH2SO4 |
I.已知:2NO(g)+O2(g)=2NO2(g)△H=b kJ•mol-1;CO的燃烧热为c kJ•mol-1.写出消除汽车尾气中NO2的污染时,NO2与CO反应的热化学方程式2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=a-b+2c kJ•mol-1.
II.一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
| c(CO)/mol•L-1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |

(2)前2s内的平均反应速率υ(N2)=0.09mol/(L•s)(保留两位小数,下同);此温度下,该反应的平衡常数为0.03mol•L-1.
(3)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液.已知常温下,该溶液的PH=5,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=1.7×104(已知该温度下NH3•H2O的Kb=1.7×10-5).若向此溶液中再加入少量 (NH4)2SO4固体,$\frac{c(N{H}_{4}^{+})}{c(S{O}_{4}^{2-})}$的值将变大(填“变大”、“不变”或“变小”).
III.如图2所示,用无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,在25℃和101kPa下达到平衡时,各部分体积分别为V甲、V乙.此时若去掉活塞1,不引起活塞2的移动.则x=1.5,V甲:V乙=3:1.