题目内容
25°C时将45mL0.1mol?L-1HCl溶液和5mL0.5mol?L-1 Ba(OH)2溶液相混合并稀释至500mL,所得溶液的pH等于 .
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:45mL 0.1mol/L盐酸溶液中n(H+)=0.045×0.1mol/L=0.0045mol,5mL 0.5mol/L氢氧化钡溶液中n(OH-)=0.005L×0.5mol/L×2=0.005mol,发生反应:H++OH-=H2O,可知氢氧根过量,计算剩余氢氧根的浓度,再根据c(H+)=
计算溶液氢离子浓度,最后pH=-lg c(H+)计算出稀释后溶液的pH.
| Kw |
| c(OH-) |
解答:
解:45mL 0.1mol/L盐酸溶液中n(H+)=0.045×0.1mol/L=0.0045mol,5mL 0.5mol/L氢氧化钡溶液中n(OH-)=0.005L×0.5mol/L×2=0.005mol,发生反应:H++OH-=H2O,可知氢氧根过量,
则稀释后溶液中c(OH-)=
=0.001mol/L,
稀释后溶液中c(H+)=
=1×10-11mol/L,
混合稀释后溶液的pH=-lgc(H+)=11,
故答案为:11.
则稀释后溶液中c(OH-)=
| 0.005mol-0.0045mol |
| 0.5L |
稀释后溶液中c(H+)=
| 10-14 |
| 0.001 |
混合稀释后溶液的pH=-lgc(H+)=11,
故答案为:11.
点评:本题考查酸、碱混合溶液pH计算,难度不大,注意先判断溶液酸碱性,再计算反应后剩余氢氧根离子浓度或氢离子浓度,再根据水的离子积与pH定义式计算.

练习册系列答案
相关题目
在污染环境的有害气体中,主要由于跟血红蛋白结合而引起中毒的有毒气体是( )
| A、SO2 |
| B、CO2 |
| C、NO2 |
| D、CO |
在0℃和1×105Pa 下,用铂电极电解硫酸铜溶液,当阴极产生6.4g铜时,阳极放出( )
| A、1.12 L氢气 |
| B、1.12 L氧气 |
| C、2.24 L氢气 |
| D、2.24 L氧气 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
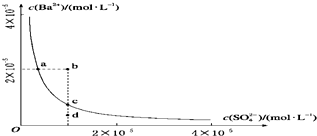

| A、加入Na2SO4可以使溶液由a点变到c点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、b、d点都是不能长时间稳定存在的点 |
| D、a点对应的Ksp大于c点对应的Ksp |
在铜-锌-硫酸构成的原电池中,经过一段时间的工作后,下列说法正确的是( )
| A、锌片是负极,铜片上有气泡冒出 |
| B、电流方向是从锌片流向铜片 |
| C、溶液中硫酸的物质的量不变 |
| D、电解液的pH保持不变 |
被誉为“光纤之父”的科学家高锟荣获2009年诺贝尔化学奖.下列叙述不正确的是( )
| A、SiO2是生产光导纤维和粗硅的主要原料 |
| B、工艺师利用盐酸刻蚀石英制作艺术品 |
| C、SiO2与CO2都属于酸性氧化物,都不能与酸反应 |
| D、水晶的主要成分是SiO2 |
下列说法正确的是( )
| A、在常温常压下,11.2LN2含有分子数为0.5NA |
| B、在常温常压下,22.4LNe含有原子数为NA |
| C、71gCl2所含有的原子数为2NA |
| D、在同温同压下,相同体积的气体单质含有原子数相同 |