题目内容
 化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛.
化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛.(1)利用氢气可以制取工业原料乙酸.已知:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
③H2(g)+
| 1 |
| 2 |
试利用上述信息计算下述反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=
(2)科学家可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的为
A.2Na+2H2O=2NaOH+H2↑ B.3Fe+2O2=Fe3O4
C.(NH4)2CO3=NH4HCO3+NH3↑ D.NaOH+HCl=NaCl+H2O
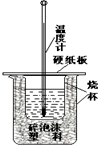
(3)实验室可以利用如图装置进行中和热测定.回答下列问题:
①请指出该装置还缺少的仪器是
②两烧杯间填满碎泡沫塑料的作用是
③若向三份等体积、等物质的量浓度的NaOH溶液中分别加入稀醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3.则三者的大小关系是
考点:热化学方程式,焓变和熵变,中和热的测定
专题:化学反应中的能量变化
分析:(1)利用盖斯定律,将②×2+③×2-①可得2C(s)+2H2(g)+O2(g)═CH3COOH(l),以此计算反应热,可得热化学方程式;
(2)物质的分解反应大多数都是吸热的,产物气体系数和大于反应物气体系数和的反应是熵增加的反应;
(3)①根据量热计的构造来判断该装置的缺少仪器;
②中和热测定实验成败的关键是保温工作;
③25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,但是弱酸的电离吸热,浓硫酸的稀释会放热.
(2)物质的分解反应大多数都是吸热的,产物气体系数和大于反应物气体系数和的反应是熵增加的反应;
(3)①根据量热计的构造来判断该装置的缺少仪器;
②中和热测定实验成败的关键是保温工作;
③25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,但是弱酸的电离吸热,浓硫酸的稀释会放热.
解答:
解:(1)利用盖斯定律,将②×2+③×2-①可得2C(s)+2H2(g)+O2(g)═CH3COOH(l),
则△H4=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol,
故答案为:-488.3kJ/mol;
(2)A.2Na+2H2O=2NaOH+H2↑是放热的,故A错误;
B.3Fe+2O2=Fe3O4是放热的,故B错误;
C.(NH4)2CO3=NH4HCO3+NH3↑属于物质的分解反应,产物气体系数和大于反应物的,是熵增加的反应,故C正确;
D.NaOH+HCl=NaCl+H2O是放热的,故D错误;
故选C.
(3)①根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故答案为:环形玻璃搅拌棒;
②中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,
故答案为:为了达到保温隔热,减少热量损失;
③25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol因醋酸是弱酸,电离时需要吸热,所以反应放出的热小于57.3kJ,浓硫酸的稀释放热,所以反应放出的热大于57.3kJ,所以Q2>Q3>Ql.
故答案为:Q2>Q3>Ql.
则△H4=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol,
故答案为:-488.3kJ/mol;
(2)A.2Na+2H2O=2NaOH+H2↑是放热的,故A错误;
B.3Fe+2O2=Fe3O4是放热的,故B错误;
C.(NH4)2CO3=NH4HCO3+NH3↑属于物质的分解反应,产物气体系数和大于反应物的,是熵增加的反应,故C正确;
D.NaOH+HCl=NaCl+H2O是放热的,故D错误;
故选C.
(3)①根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故答案为:环形玻璃搅拌棒;
②中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,
故答案为:为了达到保温隔热,减少热量损失;
③25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol因醋酸是弱酸,电离时需要吸热,所以反应放出的热小于57.3kJ,浓硫酸的稀释放热,所以反应放出的热大于57.3kJ,所以Q2>Q3>Ql.
故答案为:Q2>Q3>Ql.
点评:本题考查盖斯定律的应用、中和热的测定,明确中和热是指强酸与强碱的稀溶液发生中和反应所放出的热量是解题关键,难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
在容积为2L的密闭容器中充入2mol SO2和一定量O2,发生反应2SO2+O2?2SO3,当反应进行到4min时,测得n(SO2)=0.6mol.若反应进行到2min时,容器中SO2的物质的量是( )
| A、等于1.3mol |
| B、小于1.3mol |
| C、大于1.4mol |
| D、等于1.4mol |
下列叙述正确的是( )
| A、P4和CO2分子中都只含有共价键 |
| B、CCl4和NH3的分子的立体结构都是正四面体形 |
| C、BF3分子中各原子均达到8e-稳定结构 |
D、甲烷的结构式为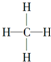 ,它是对称的平面形分子 ,它是对称的平面形分子 |
下列说法中正确的是(NA表示阿伏伽德罗常数)( )
| A、0.1mol H2O中所含的原子总数是0.3NA |
| B、在常温常压下,11.2L氯气所含的原子数为NA |
| C、标准状况下,22.4L氢气所含的质子数为2 2.4NA |
| D、2mol K2SO4中离子的总数为4NA |