题目内容
16.下列对晶体的描述不符合科学依据的是( )| A. | NaCl晶体中Na+和Cl-之间存在离子键,使得其熔沸点较高 | |
| B. | 金刚石晶体中碳原子以共价键方式形成了立体网状结构,熔沸点高、硬度大 | |
| C. | 足球烯分子间存在分子间作用力,其笼状结构分子使得其具有独特的性能 | |
| D. | 金属钠属于金属晶体,能导电、传热,有延展性,硬度大 |
分析 A.离子晶体的熔沸点由离子键强弱决定;
B.金刚石是原子晶体,熔沸点高、硬度大;
C.足球烯是分子晶体,存在分子间作用力;
D.金属钠是金属晶体,存在金属键,是良好的导体,质软.
解答 解:A.离子晶体存在离子键,离子键较强,离子晶体的熔沸点较高,故A正确;
B.金刚石是原子晶体,C原子间以共价键形成空间网状结构,熔沸点高、硬度大,故B正确;
C.足球烯C60是60个碳原子结合形成的稳定分子,其笼状结构分子使得其具有独特的性能,故C正确;
D.金属钠是金属晶体,存在金属键,能导电、传热,有延展性,用小刀就能轻轻切开金属钠,说明钠的硬度小,故D错误;
故选D.
点评 本题考查化学键与晶体及晶体熔沸点之间关系,侧重考查分析判断能力,知道常见晶体类型及分类方法,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列有关原电池的说法中不正确的是( )
| A. | 在内电路中,电子由正极流向负极 | |
| B. | 原电池的正、负极材料不一定都参与反应 | |
| C. | 原电池工作时,正极上发生还原反应 | |
| D. | 原电池工作时,可能会伴随着热能变化 |
4.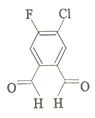 今年春节期间,一个名叫“福(氟)禄(氯)双全(醛)”的物质 (结构简式如图)在化学人的朋友圈中火了起来.该物质属于( )
今年春节期间,一个名叫“福(氟)禄(氯)双全(醛)”的物质 (结构简式如图)在化学人的朋友圈中火了起来.该物质属于( )
 今年春节期间,一个名叫“福(氟)禄(氯)双全(醛)”的物质 (结构简式如图)在化学人的朋友圈中火了起来.该物质属于( )
今年春节期间,一个名叫“福(氟)禄(氯)双全(醛)”的物质 (结构简式如图)在化学人的朋友圈中火了起来.该物质属于( )| A. | 单质 | B. | 无机物 | C. | 有机物 | D. | 氧化物 |
11.下列对元素周期表的结构描述正确的是( )
| A. | 具有相同电子层数而又按原子序数递增顺序排列的横行称为周期 | |
| B. | 元素周期表共有14列元素:7个主族和7个副族 | |
| C. | 元素周期表的第一列元素称为第IA族,均为活泼的金属元素 | |
| D. | 元素周期表中第二周期第VIIA族元素的最高正价为+7价 |
1.用疏松多孔的活性炭插入KOH溶液作电极,在两极上分别通入甲烷和氧气,形成燃料电池,有关该电池的描述错误的是( )
| A. | 电池总反应:CH4+2O2+2OH-═CO32-+3H2O | |
| B. | 负极反应式:CH4-8e-+10OH-═CO32-+7H2O | |
| C. | 正极反应式:O2+4H++4e-═2H2O | |
| D. | CH4燃料电池比CH4直接燃烧能量利用率高 |
8.下列关于离子键、共价键的叙述中正确的是( )
| A. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| B. | 在共价化合物里,可能存在离子键 | |
| C. | 在离子化合物里,只存在离子键,没有共价键 | |
| D. | 化学反应的实质是旧键的断裂,新键的形成 |
5.按钠、钾、铷、铯的顺序,下列有关叙述正确的是( )
| A. | 其氢氧化物中碱性最强的是NaOH | B. | 单质还原能力最强的是铯 | ||
| C. | 单质熔点最低的是钠 | D. | 原子半径逐渐减少 |
6.对下列药品或事故的处理正确的是( )
| A. | 金属钠着火燃烧时用砂子灭火 | |
| B. | 氯水保存在无色透明的试剂瓶中 | |
| C. | 漂白粉保存在烧杯中 | |
| D. | 大量氯气泄漏时用氢氧化钠溶液浸湿的软布蒙面并迅速离开现场 |
 ;
;