题目内容
15. 研究发现,可以用石墨作阳极、钛网作阴极、熔融的 CaF2-CaO 作电解质,利用如图 所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融的 CaF2-CaO 作电解质,利用如图 所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( )| A. | 由 TiO2 制得 1 mol 金属 Ti,理论上外电路通过 2 mol 电子 | |
| B. | 阳极的电极反应式为 C+2O2--4e-═CO2↑ | |
| C. | 在制备金属钛前后,整套装置中 CaO 的总量减少 | |
| D. | 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接 Pb 电极 |
分析 A.由TiO2制得1mol金属Ti,理论上外电路转移4mol电子;
B.根据图知,阳极上C失电子和氧离子反应生成二氧化碳;
C.左边装置中氧化钙生成钙离子和氧离子,右边装置中钙离子结合氧离子生成氧化钙;
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接PbO2电极.
解答 解:A.由TiO2制得1mol金属Ti,Ti元素化合价由+4价变为0价,所以理论上外电路转移4mol电子,故A错误;
B.根据图知,阳极上C失电子和氧离子反应生成二氧化碳,电极反应式为C+2O2--4e-═CO2↑,故B正确;
C.左边装置中氧化钙生成钙离子和氧离子,右边装置中钙离子结合氧离子生成氧化钙,所以整套装置中CaO的总量不变,故C错误;
D.若用铅蓄电池作该装置的供电电源,铅蓄电池放电时,二氧化铅作阳极,所以“+”接线柱应连接PbO2电极,故D错误;
故选B.
点评 本题考查电解原理,正确理解图片中所含信息是解本题关键,知道石墨、钛网、金属钛的作用及发生的反应是解本题关键,题目难度中等.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
15.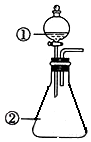 用图装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
 用图装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| D | 液溴 | 苯 | 生成白雾 |
| A. | A | B. | B | C. | C | D. | D |
16.下列有关原电池的说法中不正确的是( )
| A. | 在内电路中,电子由正极流向负极 | |
| B. | 原电池的正、负极材料不一定都参与反应 | |
| C. | 原电池工作时,正极上发生还原反应 | |
| D. | 原电池工作时,可能会伴随着热能变化 |
10.某同学按下列步骤配制500mL 0.200mol•L-1 Na2CO3溶液,请回答有关问题.
你认为按上述步骤配制的Na2CO3溶液的浓度是否为0.200mol•L-1,请说明理由.
| 实验步骤 | 有关问题 |
| (1)计算所需Na2CO3的质量 | 需要Na2CO3的质量为10.6g. |
| (2)称量Na2CO3固体 | 称量过程中主要用到的仪器是托盘天平、砝码、药匙. |
| (3)将Na2CO3加入100mL烧杯中 | 为加快溶解速率,可采取的措施是用玻棒搅拌或加热 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应采取的措施是用玻璃棒引流 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是当加水璃刻度线1-2cm时改用胶头璃管加水至凹液面与刻度线相切 |
4.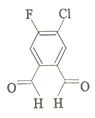 今年春节期间,一个名叫“福(氟)禄(氯)双全(醛)”的物质 (结构简式如图)在化学人的朋友圈中火了起来.该物质属于( )
今年春节期间,一个名叫“福(氟)禄(氯)双全(醛)”的物质 (结构简式如图)在化学人的朋友圈中火了起来.该物质属于( )
 今年春节期间,一个名叫“福(氟)禄(氯)双全(醛)”的物质 (结构简式如图)在化学人的朋友圈中火了起来.该物质属于( )
今年春节期间,一个名叫“福(氟)禄(氯)双全(醛)”的物质 (结构简式如图)在化学人的朋友圈中火了起来.该物质属于( )| A. | 单质 | B. | 无机物 | C. | 有机物 | D. | 氧化物 |
5.按钠、钾、铷、铯的顺序,下列有关叙述正确的是( )
| A. | 其氢氧化物中碱性最强的是NaOH | B. | 单质还原能力最强的是铯 | ||
| C. | 单质熔点最低的是钠 | D. | 原子半径逐渐减少 |
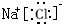 ;
;