题目内容
3.下列实验或操作能达到目的是( )| A. | 用AgNO3溶液鉴别KCl溶液和MgCl2溶液 | |
| B. | 用BaCl2溶液鉴别Na2CO3溶液与Na2SO4溶液 | |
| C. | 用加热、称重的方法鉴别NaCl固体和Ca(HCO3)2固体 | |
| D. | 检验某溶液中是否含有H+时,可滴入少量的酚酞试液 |
分析 A.二者均与硝酸银反应生成AgCl沉淀;
B.均与氯化钡反应生成白色沉淀;
C.碳酸氢钙加热分解,而NaCl不能;
D.酚酞遇酸不变色.
解答 解:A.二者均与硝酸银反应生成AgCl沉淀,现象相同,不能鉴别,故A错误;
B.均与氯化钡反应生成白色沉淀,现象相同,不能鉴别,故B错误;
C.碳酸氢钙加热分解,而NaCl不能,则用加热、称重的方法可鉴别,故C正确;
D.酚酞遇酸不变色,则酚酞不能鉴别溶液中是否含有H+,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、鉴别和检验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
19.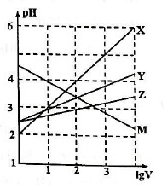 常温下取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时可能有如下的曲线,则下列说法正确的是( )
常温下取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时可能有如下的曲线,则下列说法正确的是( )
 常温下取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时可能有如下的曲线,则下列说法正确的是( )
常温下取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时可能有如下的曲线,则下列说法正确的是( )| A. | X是HA,M是HB | |
| B. | 常温下PH:NaA溶液>NaB溶液 | |
| C. | 对于$\frac{c({R}^{-})}{c(HR)c(O{H}^{-})}$的值(R代表A或B),一定存在HA>HB | |
| D. | 若常温下浓度均为0.1mol•L-1的NaA和HA的混合溶液的PH>7,则c(A-)>c(HA) |
4.下列实验方案中,能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| ① | 检验淀粉是否水解生成葡萄糖 | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后水解液用NaOH溶液中和,然后再加入新制Cu(OH)2浊液,加热,观察是否有红色沉淀生成 |
| ② | 比较H2CO3、HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液 的pH值,比较pH大小 |
| ③ | 区别植物油和矿物油 | 向植物油和矿物油中分别加入烧碱溶液,加热,冷却后观察是否分层 |
| ④ | 验证CaCO3的溶解度小于CaSO4 | 将浓Na2CO3溶液加入CaSO4悬浊液中,充分振荡,过滤、洗涤,向所得固体中滴加盐酸,观察是否有气体生成 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①③ |
8.下面是人们对于化学科学的各种常见认识,其中正确的是( )
| A. | 实验是认知化学的唯一手段 | |
| B. | 化学是一门具有较强实用性的科学 | |
| C. | 化学支持高新技术的快速发展,但面对伪科学和人体健康等问题却显得无能为力 | |
| D. | 分子是化学变化中的最小微粒 |
12.取80毫升的水,最合适的仪器是( )
| A. | 天平(附砝码) | B. | 10毫升的量筒 | C. | 20毫升的量筒 | D. | 100毫升的量筒 |
13.下列物质中,不属于高分子化合物的是( )
| A. | 塑料 | B. | 淀粉 | C. | 油脂 | D. | 纤维素 |
 亚硝酸钠(NaNO,)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和过氧化钠为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO,)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和过氧化钠为原料制备亚硝酸钠的装置如图所示. 经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知这种溶液中含有一种或两种溶质.查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,试完成下列各题.
经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知这种溶液中含有一种或两种溶质.查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,试完成下列各题.