题目内容
 化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:
化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:(1)铜钱在我国历史上曾经是一种广泛流通的货币,铜常用于制造货币的原因可能是
A.铜的熔点不是太高,易于冶炼,铸造成型
B.铜的性质不活泼,不易被腐蚀
C.我国较早的掌握了湿法冶炼铜的技术
D.自然界有大量的游离态的铜
(2)钢铁制品的使用更为广泛,但是铁制品易生锈,铁锈的主要成分是
(3)铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易 被酸碱破坏,若使氧化铝与氧氧化钠溶液作用,反应的化学方程式为:
考点:合金的概念及其重要应用
专题:元素及其化合物
分析:(1)Cu的性质较不活泼,提炼技术较早发现,且熔点不高,不易腐蚀,所以应用广泛;
(2)铁和碳在电解质溶液中发生电化腐蚀生成铁锈氧化铁,常见铁的氧化物为氧化亚铁,四氧化三铁;
(3)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水.
(2)铁和碳在电解质溶液中发生电化腐蚀生成铁锈氧化铁,常见铁的氧化物为氧化亚铁,四氧化三铁;
(3)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水.
解答:
解:(1)A.铜的熔点不是太高,易于冶炼、铸造成型,可应用于制造货币,故A正确;
B.铜的性质不活泼,不与空气中的水氧气等反应,不易被腐蚀,故B正确;
C.我国较早的掌握了湿法冶炼铜的技术,利用Fe与硫酸铜反应生成Cu,故C正确;
D.自然界有大量铜矿,开采后提炼Cu,故D错误;
故答案为:ABC;
(2)铁制品易生锈,铁锈的主要成分是三氧化二铁;常见铁的氧化物有FeO;Fe3O4;
故答案为:三氧化二铁;FeO;Fe3O4;
(3)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,该反应为Al2O3+2NaOH═2NaAlO2+H2O,离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2NaOH═2NaAlO2+H2O;Al2O3+2OH-=2AlO2-+H2O.
B.铜的性质不活泼,不与空气中的水氧气等反应,不易被腐蚀,故B正确;
C.我国较早的掌握了湿法冶炼铜的技术,利用Fe与硫酸铜反应生成Cu,故C正确;
D.自然界有大量铜矿,开采后提炼Cu,故D错误;
故答案为:ABC;
(2)铁制品易生锈,铁锈的主要成分是三氧化二铁;常见铁的氧化物有FeO;Fe3O4;
故答案为:三氧化二铁;FeO;Fe3O4;
(3)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,该反应为Al2O3+2NaOH═2NaAlO2+H2O,离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2NaOH═2NaAlO2+H2O;Al2O3+2OH-=2AlO2-+H2O.
点评:本题考查氧化铝和Cu的性质,把握氧化铝的两性及Cu的活泼性与使用历史的关系为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
在由CuSO4、H2SO4组成的混合溶液中,加入过量的铁粉,充分反应后过滤.下列有关该实验的叙述正确的是( )
| A、滤液中含有Cu2+ |
| B、反应中一定有气体产生 |
| C、滤出的固体可能是纯净物 |
| D、溶液的质量一定会减小 |
下列说法中不正确的是(
| A、煤、石油、天然气均为化石能源 |
| B、化石燃料在燃烧过程中能产生污染环境的SO2等有害气体 |
| C、直接燃烧煤不如将煤进行深加工后再燃烧效果好 |
| D、化石能源是可再生能源 |
下列化合物在一定的条件下,既能发生消去反应又能发生水解反应的是( )
①CH3Cl ② ③
③ ④
④
①CH3Cl ②
 ③
③ ④
④
| A、② | B、①② |
| C、②③④ | D、①②③④ |
 A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体化合物.它们按如图所示的关系相互转化,已知A为单质.分别写出有关反应的化学方程式.
A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体化合物.它们按如图所示的关系相互转化,已知A为单质.分别写出有关反应的化学方程式.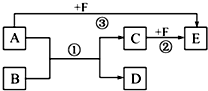 已知:A、B、C、D、E、F是中学化学教材中六种常见的物质,它们之间有如图所示的相互转化关系(反应条件及部分产物未标出).请回答下列问题:
已知:A、B、C、D、E、F是中学化学教材中六种常见的物质,它们之间有如图所示的相互转化关系(反应条件及部分产物未标出).请回答下列问题: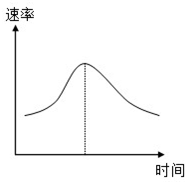 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随c(H+)的增大而增强,有关方程式为:ClO3-+3HSO3-?Cl-+3H++3SO42-
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随c(H+)的增大而增强,有关方程式为:ClO3-+3HSO3-?Cl-+3H++3SO42- I、根据如图回答
I、根据如图回答 2SO3反应,
2SO3反应,