题目内容
在由CuSO4、H2SO4组成的混合溶液中,加入过量的铁粉,充分反应后过滤.下列有关该实验的叙述正确的是( )
| A、滤液中含有Cu2+ |
| B、反应中一定有气体产生 |
| C、滤出的固体可能是纯净物 |
| D、溶液的质量一定会减小 |
考点:铁的化学性质
专题:元素及其化合物
分析:把过量的铁粉加入到H2SO4和CuSO4的混合溶液中,发生反应为①Fe+CuSO4═FeSO4+Cu;②Fe+H2SO4═FeSO4+H2↑,加入过量铁粉,H2SO4和CuSO4都完全反应,以此来解答.
解答:
解:加入过量的铁粉,发生Fe+CuSO4═FeSO4+Cu、Fe+H2SO4═FeSO4+H2↑,
A.滤液中不含Cu2+,故A错误;
B.由Fe与硫酸的反应可知生成氢气,故B正确;
C.铁粉过量,则滤出的固体为Cu、Fe的混合物,故C错误;
D.该过程发生Fe+CuSO4═FeSO4+Cu,只发生该反应则溶液质量会减小,而发生Fe+H2SO4═FeSO4+H2↑时溶液质量会增大,故溶液的质量有可能减小,也可能增大,故D错误;
故选B.
A.滤液中不含Cu2+,故A错误;
B.由Fe与硫酸的反应可知生成氢气,故B正确;
C.铁粉过量,则滤出的固体为Cu、Fe的混合物,故C错误;
D.该过程发生Fe+CuSO4═FeSO4+Cu,只发生该反应则溶液质量会减小,而发生Fe+H2SO4═FeSO4+H2↑时溶液质量会增大,故溶液的质量有可能减小,也可能增大,故D错误;
故选B.
点评:本题考查铁的化学性质,为高频考点,把握铁粉过量发生的置换反应为解答的关键,注意选项D为解答的易错点,硫酸和硫酸铜的量不确定,则不能确定溶液质量增加还是减少,题目难度不大.

练习册系列答案
相关题目
已知某反应的各物质浓度数据如下:aA(气)+bB(气)?cC(气)
由此可推算出上述方程式中各物质前面的化学计量数之比是( )
| 起始浓度(mol/L) | 3.2 | 0.8 | 0.0 |
| 2s末浓度(mol/L) | 2.0 | 0.4 | 0.8 |
| A、1:2:4 |
| B、4:1:2 |
| C、3:1:2 |
| D、3:2:1 |
“春蚕到死丝方尽”这句诗中的“丝”的主要成分是( )
| A、糖类 | B、油脂 |
| C、蛋白质 | D、烃类物质 |
标准状况下在体积为1L的干燥烧瓶中,用排空气法收集HCl气体,将烧瓶倒置于装有足量水的水槽中,不考虑烧瓶内液体与水槽中液体的扩散,则烧瓶中所得溶液的物质的量浓度是( )
| A、0.045mol/L |
| B、0.0224 mol/L |
| C、0.017 mol/L |
| D、0.059 mol/L |
下列说法正确的是( )
| A、常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 |
| B、Si-O键的键能大于Si-Cl键的键能,因此SiO2的熔点高于晶体SiCl4的熔点 |
| C、稀醋酸与0.1mol/L NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol |
D、 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1,如图可表示由CO生成CO2的反应过程和能量关系 |
下列结论正确的是( )
| A、酸碱中和反应能生成盐和水,所以生成盐和水的反应一定是中和反应 |
| B、饱和溶液降低温度一定会析出晶体 |
| C、组成元素相同的物质化学性质不一定相同 |
| D、质子数相同的两种粒子其核外电子数一定相等 |
常温下,下列情况中,一定能大量共存于同一溶液中的离子组是( )
| A、使甲基橙呈红色的溶液中:I-、Cl-、NO3-、Na+ | ||
| B、FeCl3溶液中:K+、Na+、SO42-、AlO2- | ||
C、
| ||
| D、Al2(SO4)3溶液中:K+、Cu2+、Na+、CO32- |
新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下,下列说法正确的是( )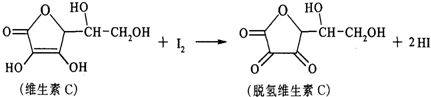

| A、上述反应为取代反应 |
| B、维生素C能抗衰老是因为有氧化性 |
| C、滴定时可用淀粉溶液作指示剂 |
| D、维生素C能发生银镜反应 |
 化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:
化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题: