题目内容
将一定质量的锌片放入500mL CuSO4溶液中,二者恰好完全反应,待充分反应后取出锌片,洗净后称量,发现锌片比原来减轻了0.5g,则该CuSO4溶液的物质的量浓度为 .
考点:化学方程式的有关计算
专题:计算题
分析:发生反应Zn+CuSO4=Cu+ZnSO4,根据固体质量差计算参加反应 CuSO4的物质的量,根据c=
计算浓度.
| n |
| V |
解答:
解:Zn+CuSO4 =Cu+ZnSO4 质量减轻△m
65g 1mol 64g 1g
n 0.5g
n=
0.5mol,c=
=1.0mol/L
故答案为:1.0.
65g 1mol 64g 1g
n 0.5g
n=
| 1mol×0.5g |
| 1g |
| 0.5mol |
| 0.5L |
故答案为:1.0.
点评:本题考查根据方程式进行的计算,难度不大,注意利用差量法进行的计算,可以简化计算,差量法的本质为质量守恒.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,Y单质化学性质不活泼,而Z能形成双原子分子,是最活泼的非金属单质.根据以上叙述,下列说法中正确的是( )
| A、上述四种元素的原子半径大小为W<X<Y<Z |
| B、W、X、Y、Z原子的核外最外层电子数的总和为17 |
| C、Z元素的最高化合价为+7价 |
| D、Y元素的最高价氧化物的对应水化物能溶解所有的金属 |
已知2A(g)+B(g)?2C(g)+D(s),△H=-QkJ?mol-1,一定条件下,将2mol A和1mol B放入一体积可变的密闭容器中,测得容器体积为200L,一段时间达平衡后,测得体积变为140L,下列说法不正确的是( )
| A、平衡时A的转化率为90% |
| B、若要使达到平衡时的各气体的物质的量与题目的平衡相同,可充入2mol C和2mol D |
| C、在相同条件下,按2:1充入A和B,平衡时容器体积为210L,则充入A的物质的量为3mol |
| D、相同条件下,若充入4mol C和2mol D,达平衡时放出能量1.8QkJ |
已知NaH和H2O反应生成H2和NaOH,反应中1mol NaH( )
| A、失去1mol电子 |
| B、得到1mol电子 |
| C、失去2mol电子 |
| D、没有电子得失 |
18g某混合气体通过足量的Na2O2固体充分反应后固体增重2g,则该混合气体不可能是( )
| A、H2O、O2 |
| B、CO2、H2 |
| C、CO2、H2O、O2 |
| D、CO2、CO |
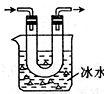
 甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.