题目内容
聚合硫酸铁(SPFS)是一种新型的饮用水处理剂和城市污水净化剂,其化学组成可表示为[Fe2(OH)n(SO4)3-
]m.某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究.请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8℃).
试剂:1.0mol?L-1的盐酸、1.0mol?L-1的KMnO4溶液、0.1mol?L-1的BaCl2溶液、20%的KSCN溶液、品红溶液、蒸馏水、冰水.
(1)聚合硫酸铁中铁元素的化合价是 .
(2)固体产物成分的探究
实验设计
思考与判断
根据上面的信息,可以确定固体产物的成分是 ;步骤1中发生反应的离子方程式为 .
(3)气体产物成分的探究(不考虑水蒸气)
提出假设
假设1:所得气体的成分是SO3;
假设2:所得气体的成分是SO2、O2;
假设3:所得气体的成分是 .
设计实验方案,验证假设
按下表的实验步骤写出预期现象与结论.
| n |
| 2 |
试剂:1.0mol?L-1的盐酸、1.0mol?L-1的KMnO4溶液、0.1mol?L-1的BaCl2溶液、20%的KSCN溶液、品红溶液、蒸馏水、冰水.
(1)聚合硫酸铁中铁元素的化合价是
(2)固体产物成分的探究
实验设计
| 实验步骤 | 现象 |
| 步骤1:取适量的固体产物于试管中,加入足量1.0mol?L-1的盐酸,充分振荡使固体完全溶解 | 固体溶解,没有观察到气泡,溶液呈黄色 |
| 步骤2:取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液,振荡 | 溶液呈血红色 |
| 步骤3:另取少量步骤1所得溶液于试管中,滴入少量1.0mol?L-1的KMnO4溶液,振荡 | KMnO4的紫红色不褪去 |
根据上面的信息,可以确定固体产物的成分是
(3)气体产物成分的探究(不考虑水蒸气)
提出假设
假设1:所得气体的成分是SO3;
假设2:所得气体的成分是SO2、O2;
假设3:所得气体的成分是
设计实验方案,验证假设
按下表的实验步骤写出预期现象与结论.
| 实验操作 | 预期现象与结论 |
| 步骤1:将少量气体产物通入盛有适量品红溶液的试管中,观察溶液的颜色变化,然后加热再观察溶液的颜色变化 | ①若 ②若 |
步骤2:将气体产物缓缓通过浸在冰水中的U形管(如图),然后在U形管中加入适量0.1mol?L-1的BaCl2溶液,充分振荡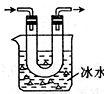 | 结合上述步骤1的有关结论 ①若 ②若 |
考点:探究物质的组成或测量物质的含量
专题:常规题型
分析:(1)根据元素化合价的代数和为零得2x-n-2(3-
)=0,x=+3价;
(2)根据现象取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液呈血红色,滴入少量1.0mol?L-1的KMnO4溶液,KMnO4的紫红色不褪去,说明该溶液含三价铁不含二价铁,实验该固体为Fe2O3,和H+反应的离子方程式为Fe2O3+6H+═2Fe3++3H2O;
(3)假设的三种情况是①SO3,②SO2、O2,③SO3、SO2、O2.若假设②③成立,若把气体通入到品红溶液中,品红褪色,则假设②、③成立;若品红不褪色,则假设①成立,根据步骤2中,生成白色沉淀,则假设③成立,若无白色沉淀,则假设②成立.
| n |
| 2 |
(2)根据现象取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液呈血红色,滴入少量1.0mol?L-1的KMnO4溶液,KMnO4的紫红色不褪去,说明该溶液含三价铁不含二价铁,实验该固体为Fe2O3,和H+反应的离子方程式为Fe2O3+6H+═2Fe3++3H2O;
(3)假设的三种情况是①SO3,②SO2、O2,③SO3、SO2、O2.若假设②③成立,若把气体通入到品红溶液中,品红褪色,则假设②、③成立;若品红不褪色,则假设①成立,根据步骤2中,生成白色沉淀,则假设③成立,若无白色沉淀,则假设②成立.
解答:
解:(1)根据元素化合价的代数和为零得2x-n-2(3-
)=0,x=+3价,故答案为:+3;
(2)根据现象取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液呈血红色,滴入少量1.0mol?L-1的KMnO4溶液,KMnO4的紫红色不褪去,说明该溶液含三价铁不含二价铁,实验该固体为Fe2O3,和H+反应的离子方程式为Fe2O3+6H+═2Fe3++3H2O,故答案为:Fe2O3;Fe2O3+6H+═2Fe3++3H2O;
(3)假设的三种情况是①SO3,②SO2、O2,③SO3、SO2、O2.若假设②③成立,若把气体通入到品红溶液中,品红褪色,加热后又恢复红色,则假设2、3成立;若品红不褪色,则假设1成立;根据步骤2中,因为SO2与BaCl2溶液不反应,而SO3与BaCl2溶液反应生成硫酸钡的白色沉淀,所以若生成白色沉淀,则假设3成立,若无白色沉淀,则假设2成立,故答案为:SO3、SO2、O2;
| n |
| 2 |
(2)根据现象取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液呈血红色,滴入少量1.0mol?L-1的KMnO4溶液,KMnO4的紫红色不褪去,说明该溶液含三价铁不含二价铁,实验该固体为Fe2O3,和H+反应的离子方程式为Fe2O3+6H+═2Fe3++3H2O,故答案为:Fe2O3;Fe2O3+6H+═2Fe3++3H2O;
(3)假设的三种情况是①SO3,②SO2、O2,③SO3、SO2、O2.若假设②③成立,若把气体通入到品红溶液中,品红褪色,加热后又恢复红色,则假设2、3成立;若品红不褪色,则假设1成立;根据步骤2中,因为SO2与BaCl2溶液不反应,而SO3与BaCl2溶液反应生成硫酸钡的白色沉淀,所以若生成白色沉淀,则假设3成立,若无白色沉淀,则假设2成立,故答案为:SO3、SO2、O2;
| 预期现象与结论 |
| ①若 品红溶液不褪色,则 假设1成立 ②若 品红溶液褪色,加热后又恢复红色,则 假设2或3成立 |
| 结合步骤1中的 ② ①若 无白色沉淀生成,则 假设2成立 ②若 有白色沉淀生成,则 假设3成立 |
点评:本题属于实验探究题,考查知识较为基本,但本题得分不高,主要原因是化学用语不规范,现象回答不准确,漏写关键点造成的,平时应该建立纠错笔记,加强规范化训练.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
短周期主族元素X、Y、Z、W的原子序数依次增大,X元素的原子半径最小,Z元素和X元素在一定条件下能形成XZ,Y和W的原子序数相差8,W和Y可形成两种常见的气态化合物.下列叙述正确的是( )
| A、X与Y可形成原子个数比1:1的化合物 |
| B、化合物XZ的沸点高于X与Y形成化合物的沸点 |
| C、W的含氧酸是一种强酸 |
| D、原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) |
将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H2 2.8L(标准状况),原混合物的质量一定不可能是( )
| A、5g | B、4g | C、8g | D、10g |
一定温度下,在一个容积可变的密闭容器中,发生C(s)+H2O(g)?CO(g)+H2(g)反应,下列能判断该反应达到化学平衡状态的是( )
| A、容器中的压强不变 |
| B、2 mol H-O键断裂的同时1 mol H-H键形成 |
| C、c(CO)=c(H2) |
| D、密闭容器的容积不再改变 |
VmLAl2(SO4)3溶液中含Al3-ag,取
mL溶液加水稀释到10VmL,则稀释后溶液中SO42-的物质的量浓度是( )
| V |
| 10 |
A、
| ||
B、
| ||
C、
| ||
D、
|