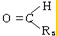题目内容
某金属氯化物ACl281g,含有1.2molCl-,则该氯化物的摩尔质量为 ,金属A的相对原子质量为 .写出硫酸铝的电离方程式 .
考点:物质的量的相关计算,电离方程式的书写
专题:计算题
分析:根据n(ACl2)=
n(Cl-)计算81gACl2的物质的量,根据M=
计算其摩尔质量,进而确定A的相对原子质量;硫酸铝完全电离得到铝离子与硫酸根离子.
| 1 |
| 2 |
| m |
| n |
解答:
解:81gACl2含有1.2molCl-,则n(ACl2)=
n(Cl-)=
×1.2mol=0.6mol,故ACl2的摩尔质量=
=135g/mol,ACl2的相对分子质量为135,则A的相对原子质量=135-35.5×2=64;
硫酸铝完全电离得到铝离子与硫酸根离子,电离方程式为:Al2(SO4)3=2Al3++3SO42-,
故答案为:135g/mol;64;Al2(SO4)3=2Al3++3SO42-.
| 1 |
| 2 |
| 1 |
| 2 |
| 81g |
| 0.6mol |
硫酸铝完全电离得到铝离子与硫酸根离子,电离方程式为:Al2(SO4)3=2Al3++3SO42-,
故答案为:135g/mol;64;Al2(SO4)3=2Al3++3SO42-.
点评:本题考查物质的量有关计算、电离方程式,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
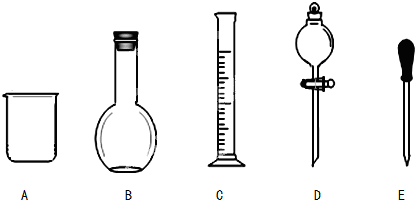
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2,则线段BC表示
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2,则线段BC表示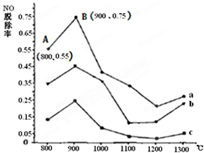
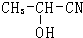
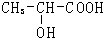
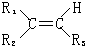
 +
+