题目内容
下列离子方程式书写正确的是( )
| A、向水中通入氯气:Cl2+H2O═2H++Cl-+ClO- |
| B、向氯化铁溶液中加入铜:2Fe3++3Cu═2Fe+3Cu2+ |
| C、将含等物质的量的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、镁和稀硝酸反应:Mg+2H+═Mg2++H2↑ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.次氯酸为弱电解质,不能拆;
B.得失电子不守恒;
C.等物质的量的NaHCO3和Ba(OH)2溶液,反应生成碳酸钡和氢氧化钠、水;
D.硝酸具有强的氧化性,与金属反应不能产生氢气.
B.得失电子不守恒;
C.等物质的量的NaHCO3和Ba(OH)2溶液,反应生成碳酸钡和氢氧化钠、水;
D.硝酸具有强的氧化性,与金属反应不能产生氢气.
解答:
解:A.向水中通入氯气,离子方程式:Cl2+H2O═H++Cl-+HClO,故A错误;
B.向氯化铁溶液中加入铜,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故BC错误;
C.将含等物质的量的NaHCO3和Ba(OH)2溶液混合,离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O,故C正确;
D.镁和稀硝酸反应,离子方程式:3Mg+8H++2NO3-=3Mg2++2NO↑+4H2O,故D错误;
故选:C.
B.向氯化铁溶液中加入铜,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故BC错误;
C.将含等物质的量的NaHCO3和Ba(OH)2溶液混合,离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O,故C正确;
D.镁和稀硝酸反应,离子方程式:3Mg+8H++2NO3-=3Mg2++2NO↑+4H2O,故D错误;
故选:C.
点评:本题考查离子方程式的书写,解题时注意从化学式、离子符号、电荷守恒、是否符合反应实际的角度分析离子方程式的书写是否正确,题目难度不大.

练习册系列答案
相关题目
在标准状况下,A L NH3溶于B mL水中,得到密度为ρg/cm3的R L氨水,则此氨水的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
将含有0.20mol的碳酸钠的液体逐滴加入到200mL的某浓度的盐酸溶液中,有标准状况下3.36L的气体产生,若改将该盐酸溶液逐滴加入原碳酸钠溶液中,则产生标况下气体的体积为( )
| A、0L | B、2.24L |
| C、3.36L | D、4.48L |
下列实验所对应的离子方程式正确的是( )
| A、向NaAlO2溶液中通入少量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| B、向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ |
| C、在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O |
| D、向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:4Fe2++2[Fe(CN)6]4-═Fe4[Fe(CN)6]2↓ |
某同学用50mL 0.50mol?L-1的盐酸与50mL0.55mol?L-1的氢氧化钠溶液进行中和反应并计算中和热.造成测得的结果偏高的原因可能是( )
| A、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 |
| B、做本实验的当天室温较高 |
| C、将50mL 0.55mol?L-1的氢氧化钠溶液取成了50mL 0.55mol?L-1的氨水 |
| D、在量取盐酸时仰视读数 |
下列关于电解质溶液的说法正确的是( )
| A、将等物质的量浓度的NaHCO3与Na2CO3溶液等体积混合,所得混合液中有:c(CO32-)+2c(OH-)═2c(H+)+c(HCO3-)+3c(H2CO3) |
| B、1L pH=3的H2SO4溶液与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |
| C、NaHS溶液呈碱性,是因HS-发生水解,其水解离子方程式为:HS-+H2O?S2-+H3O+ |
| D、pH=9的CH3COONa溶液和pH=9的NH3?H2O溶液,两溶液中水的电离程度相同 |
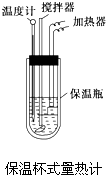 在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.