题目内容
3.铅、二氧化铅、氟硼酸(HBF4)电池是一种低温性能优良的电池,常用于军事和国防工业,其总反应方程式为Pb+PbO2+4HBF4$?_{充电}^{放电}$2Pb(BF4)2+2H2O[已知:HBF4、Pb(BF4)2均是易溶于水的强电解质].下列说法中正确的是( )| A. | 放电时,负极质量增加 | |
| B. | 放电时,溶液中的BF4-向正极移动 | |
| C. | 充电时,阳极附近溶液的酸性增强 | |
| D. | 充电时,阴极的电极反应式为Pb2+-2e-═Pb |
分析 原电池的总反应为:Pb+PbO2+4HBF4$?_{充电}^{放电}$2Pb(BF4)2+2H2O,故放电时负极反应为:Pb-2e-=Pb2+;正极反应:PbO2+2e-+4H+=Pb2++2H2O,阴离子移向负极,阳离子移向正极;充电时,阴极反应:Pb2++2e-=Pb,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,阴离子移向阳极,阳离子移向阴极.据此分析.
解答 解:原电池的总反应为:Pb+PbO2+4HBF4$?_{充电}^{放电}$2Pb(BF4)2+2H2O,故放电时负极反应为:Pb-2e-=Pb2+;正极反应:PbO2+2e-+4H+=Pb2++2H2O,阴离子移向负极,阳离子移向正极;充电时,阴极反应:Pb2++2e-=Pb,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,阴离子移向阳极,阳离子移向阴极.
A、放电时,此装置为原电池,放电时负极反应为:Pb-2e-=Pb2+,负极的质量减小,故A错误;
B、放电时,此装置为原电池,阴离子BF4-要向负极移动,故B错误;
C、充电时,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,产生大量氢离子,故阳极附近溶液的酸性增强,故C正确;
D、充电时的阴极反应即是将放电时的负极反应倒过来,故阴极反应为:Pb2++2e-=Pb,故D错误.
故选C.
点评 本题考查了原电池和电解池中电极反应式的书写和离子移动方向的判断,应注意的是在原电池中,阴离子移向负极,阳离子移向正极;在电解池中,阴离子移向阳极,阳离子移向阴极,题目难度中等.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
14.可逆反应FeCl3+3KSCN?Fe(SCN)3+3KCl达到化学平衡后,加人少量的水,平衡的移动情况为( )
| A. | 不移动 | B. | 平衡左移 | C. | 平衡右移 | D. | 无法确定 |
18.下列关于物质的检验说法不正确的是( )
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定含有SO42- | |
| B. | 观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察 | |
| C. | 待检液加入NaOH 溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ | |
| D. | 取少量久置的Na2SO3 样品于试管中加水溶解,再加入足量盐酸有气体产生,然后加入BaCl2 溶液有白色沉淀产生,说明Na2SO3 样品已部分被氧化 |
8.下列溶液中,常温下可以用铁罐装运的是( )
| A. | 浓盐酸 | B. | 稀硫酸 | C. | 硫酸铜溶液 | D. | 浓硝酸 |
12.下列各反应的产物与反应物用量无关的是( )
| A. | Na2CO3和稀盐酸 | B. | Al2O3和NaOH溶液 | ||
| C. | NH4HCO3和NaOH溶液 | D. | CO2和NaOH溶液 |
13.下列离子方程式的书写与所给的前提条件不相吻合的是( )
| A. | 将4 molCl2通入到含4 mol FeBr2的溶液中:2Cl2+2Fe2++2Br-=4Cl-+Br2+2Fe3+ | |
| B. | 已知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)要大.将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:2AlO2-+SO2+3 H2O=2 Al(OH)3↓+SO32- | |
| C. | 稀氨水吸收了少量的二氧化碳气体:2NH3•H2O+CO2=2NH4++H2O+CO32- | |
| D. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大时发生的离子反应是:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |
 .Y2Z3遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.
.Y2Z3遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.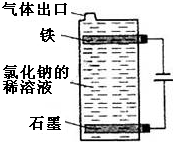 (1)按如图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;
(1)按如图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;