题目内容
15.根据如图所示情况,判断下列说法中正确的是 ( )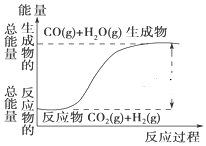
| A. | 其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=41kJ•mol-1 | |
| B. | 该反应为吸热反应 | |
| C. | 该反应为放热反应 | |
| D. | 当H2O为液态时,其反应热值大于41kJ•mol-1. |
分析 由图可知反应物能量小于生成物,正反应吸热,热化学方程式为:CO2(g)+H2(g)=CO(g)+H2O(g)△H=41kJ•mol-1,水由气态变为液态放热,以此解答该题.
解答 解:A.该反应热化学方程式为:CO2(g)+H2(g)=CO(g)+H2O(g)△H=+41kJ•mol-1,故A错误;
B.反应物能量小于生成物,正反应吸热,故B正确;
C.由B分析可知正反应吸热,故C错误;
D.水由气态变为液态放热,所以该反应吸热减少,其反应热的值小于41kJ•mol-1,故D错误.
故选B.
点评 本题考查化学反应中的能量变化,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注重基础知识的考查.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
5.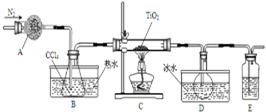 实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.
实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.
(1)仪器A的名称是干燥管,装置E中的试剂是浓硫酸.反应开始前依次进行如下操作:组装仪器、检验气密性、加装药品、通N2一段时间后点燃酒精灯.
(2)反应结束后的操作包括:a停止通N2 b熄灭酒精灯 c冷却至室温.正确的顺序为bca(填序号).选择这种顺序的理由是防止倒吸或避免生成的产物在受热情况下与氧气反应(二者任写其一均给分);欲分离D中的液态混合物,所采用操作的名称是蒸馏.
 实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.
实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产白雾 |
(2)反应结束后的操作包括:a停止通N2 b熄灭酒精灯 c冷却至室温.正确的顺序为bca(填序号).选择这种顺序的理由是防止倒吸或避免生成的产物在受热情况下与氧气反应(二者任写其一均给分);欲分离D中的液态混合物,所采用操作的名称是蒸馏.
6.在容积为2L的容器内,发生反应2A(s)+3B(g)?2C(g)+D(g),起始时充入3molA和2.5molB混合气体;经过5min达到平衡,生成0.5molD,下列说法正确的是( )
| A. | 若单位时间内生成的B和D的物质的量之比为3:1,则体系处于平衡状态 | |
| B. | C的平衡浓度为1mol/L | |
| C. | 5min内B的平均消耗速率为0.3mol/(L•min) | |
| D. | 平衡后,增大压强,平衡向正反应方向移动 |
3.石墨和金刚石都是碳元素的单质,石墨在一定条件下可转化为金刚石.已知12克石墨完全转化成金刚石时,要吸收EkJ的能量,下列说法正确的是( )
| A. | 石墨不如金刚石稳定 | |
| B. | 金刚石不如石墨稳定 | |
| C. | 金刚石和石墨的转化是物理变化 | |
| D. | C(s,金刚石)═C(s,石墨)△H=-1.9 kJ•mol-1 |
20.有关键能数据如表:
晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)═SiO2(s)△H=-989.2kJ•mol-1,则表中X的值为( )
| 化学键 | Si-O | O=O | Si-Si |
| 键能kJ•mol-1 | 460 | 498.8 | X |
| A. | 423.3 | B. | 352 | C. | 920 | D. | 176 |
7.下列电离方程式中,正确的是( )
| A. | H2SO4=H2++SO42- | B. | Ba(OH)2=Ba2++OH- | ||
| C. | KClO3=K++ClO3- | D. | MgSO4═Mg+2+SO42- |