题目内容
18.X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素.有关信息如表:| 原子或分子相关信息 | 单质及其化合物相关信息 | |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的$\frac{1}{2}$ | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(2)X的简单阴离子的结构示意图为
 ,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.
,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.(3)Z的氧化物在通讯领域用来作光导纤维,工业上制备Z的单质的化学反应方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应但在有H2O2 存在时可与NaOH 溶液反应生成锗酸盐,其方程式为Ge+2 H2O2+2NaOH=Na2GeO3+3H2O.
(4)在50mL l mol•L-1的YX3溶液中逐滴加入0.5mol•L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积可能二种情况(填一或二).
分析 X、Y、Z为短周期元素,X的最高价氧化物对应的水化物为无机酸中最强酸,则X为Cl;Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料,Y原子的最外层电子数等于电子层数,则Y为Al;Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,原子的最外层电子数是次外层电子数的$\frac{1}{2}$,则Z为Si;W原子的最外层电子数小于4,常见化合价有+3、+2,WX3稀溶液呈黄色,则W为Fe.
解答 解:X、Y、Z为短周期元素,X的最高价氧化物对应的水化物为无机酸中最强酸,则X为Cl;Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料,Y原子的最外层电子数等于电子层数,则Y为Al;Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,原子的最外层电子数是次外层电子数的$\frac{1}{2}$,则Z为Si;W原子的最外层电子数小于4,常见化合价有+3、+2,WX3稀溶液呈黄色,则W为Fe.
(1)W为Fe,在周期表的位置为第四周期第Ⅷ族,Fe(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:第四周期第Ⅷ族;4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(2)X的简单阴离子为Cl-,结构示意图为 ,X的最高价氧化物对应水化物为高氯酸,Y的氧化物为氧化铝,反应的离子方程式为:6H++Al2O3=2Al3++3H2O,
,X的最高价氧化物对应水化物为高氯酸,Y的氧化物为氧化铝,反应的离子方程式为:6H++Al2O3=2Al3++3H2O,
故答案为: ;6H++Al2O3=2Al3++3H2O;
;6H++Al2O3=2Al3++3H2O;
(3)Z的氧化物为二氧化硅,在通讯领域用来作光导纤维,工业上制备硅的单质的化学反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
锗不与NaOH 溶液反应但在有H2O2 存在时可与NaOH 溶液反应生成锗酸盐,其方程式为:Ge+2 H2O2+2NaOH=Na2GeO3+3H2O,
故答案为:光导纤维;SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;Ge+2 H2O2+2NaOH=Na2GeO3+3H2O;
(4)在50mL l mol•L-1的AlCl3溶液中逐滴加入0.5mol•L-1的NaOH溶液,若铝元素全部转化为氢氧化铝沉淀,可以得到氢氧化铝为0.05L×1mol/L×78g/mol=0.39g<1.56g,故可能是NaOH不足,部分铝离子沉淀生成氢氧化铝,也可能是铝离子部分转化偏铝酸根离子,部分转化为氢氧化铝沉淀,则加入NaOH溶液的体积可能二种情况,
故答案为:二.
点评 本题考查结构性质位置关系应用,侧重对元素化合物性质与常用化学用语考查,较好的考查学生对基础知识的掌握与灵活运用能力.

 名校课堂系列答案
名校课堂系列答案
| A. | 用图甲所示装置先放出水相,再放出有机相 | |
| B. | 用图乙所示装置制取少量氯气 | |
| C. | 用图丙所示装置蒸发浓缩FeCl3溶液制备纯净的FeCl3•6H2O | |
| D. | 用图丁所示装置验证光亮的铁钉在食盐水中可发生吸氧腐蚀 |
| A. | SO2、NO2、CO2这些酸性氧化物的大量排放是造成酸雨的主要原因 | |
| B. | 用米汤可检验食用盐是否为加碘盐 | |
| C. | iPhone6s外壳上贴的碳纤维外膜是一种新型无机非金属材料 | |
| D. | “地沟油”不能食用,但对其进行分馏可获得柴油 |
| A. | 发生化学反应时,旧化学键的断裂,一定会吸收能量 | |
| B. | ∑E(反应物)>∑E(生成物)--放出能量 (其中∑E表示总能量) | |
| C. | 有能量变化的化学反应遵守质量守恒定律,但不遵守能量守恒定律 | |
| D. | 一般情况下氧化、燃烧反应都是放热反应 |
| A. | 蛋白质在酶或酸、碱的作用下能发生水解,最终生成氨基酸 | |
| B. | 人体的主要供能物质:葡萄糖、脂肪、蛋白质中,脂肪的供能最高 | |
| C. | 某些具有酸味的含有丰富维生素C的新鲜水果、蔬菜,是酸性食物 | |
| D. | 洁净的自来水是人体每天补充水分的最好选择 |
| A. | O2和O2互为同位素,化学性质相似 | |
| B. | 水是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 分子晶体中一定存在分子间作用力,但可能没有共价键 | |
| D. | 将标准状况下22.4 L 氨气溶于1 L水配成溶液,可得1 mol•L-1的氨水 |
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2- | |
| B. | 使酚酞变红的溶液中可能大量存在Na+、ClO?、SO42-、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、HCO3?、CO32- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、SCN-、SO42- |

 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (有弱碱性,易被氧化).
(有弱碱性,易被氧化).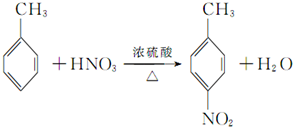 ,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.
,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.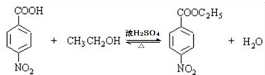 .
.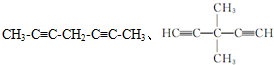 .
.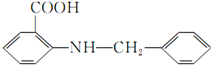 是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:

 +R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物
+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物 的质量比为
的质量比为