题目内容
8.用如图所示的装置进行实验,能达到相应实验目的是( )
| A. | 用图甲所示装置先放出水相,再放出有机相 | |
| B. | 用图乙所示装置制取少量氯气 | |
| C. | 用图丙所示装置蒸发浓缩FeCl3溶液制备纯净的FeCl3•6H2O | |
| D. | 用图丁所示装置验证光亮的铁钉在食盐水中可发生吸氧腐蚀 |
分析 A.分液时,下层液体从下口倒出,上层液体从上口倒出;
B.浓盐酸和二氧化锰在加热条件下生成氯气,不加热不反应;
C.氯化铁水解生成氢氧化铁和盐酸,升高温度促进盐酸挥发,而促进水解;
D.强酸性条件下铁钉发生析氢腐蚀,弱酸性、中性条件下生铁发生吸氧腐蚀.
解答 解:A.分液时,下层液体从下口倒出,上层液体从上口倒出,所以水相从下口倒出,有机相从上口倒出,否则易产生杂质,故A错误;
B.浓盐酸和二氧化锰在加热条件下生成氯气,不加热不反应,该实验没有加热,所以得不到氯气,故B错误;
C.氯化铁水解生成氢氧化铁和盐酸,升高温度促进盐酸挥发,而促进水解,应该在HCl氛围中加热蒸发氯化铁,故C错误;
D.强酸性条件下铁钉发生析氢腐蚀,弱酸性、中性条件下生铁发生吸氧腐蚀,食盐水溶液呈中性,所以生铁发生吸氧腐蚀,可以通过导管中红墨水变化确定是吸氧腐蚀还是析氢腐蚀,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及金属腐蚀与防护、盐类水解、气体制备、分液等知识点,明确实验原理、实验操作、物质性质是解本题关键,易错选项是C.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
4.下列有关化学用语表达不正确的是( )
| A. | 氨气分子呈正四面体空间构型 | B. | CS2分子的结构式:S═C═S | ||
| C. | S2-的结构示意图: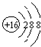 | D. | 氯化铵的电子式 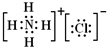 |
5.下列有关化学键的说法正确的是( )
| A. | 两个原子之间的相互作用叫做化学键 | |
| B. | 相邻原子之间的相互作用叫做化学键 | |
| C. | 一切物质中都存在化学键 | |
| D. | 破坏化学键一定要消耗能量 |
16.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
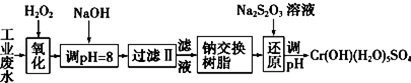
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
Ⅰ.(1)氧化过程中可代替H2O2加入的试剂是A(填序号).
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
3.下列说法正确的是( )
| A. | 很多水果具有酸味,因此在化学上称为酸性食物 | |
| B. | 为增强婴儿的食欲,应在婴儿食品中多加着色剂 | |
| C. | 多吃含钙丰富的豆腐可预防骨质疏松 | |
| D. | 为摄取足够的蛋白质,应多吃肉、少吃豆制品 |
18.X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素.有关信息如表:
(1)W在周期表的位置为第四周期第Ⅷ族,W(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3.
(2)X的简单阴离子的结构示意图为 ,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.
,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.
(3)Z的氧化物在通讯领域用来作光导纤维,工业上制备Z的单质的化学反应方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应但在有H2O2 存在时可与NaOH 溶液反应生成锗酸盐,其方程式为Ge+2 H2O2+2NaOH=Na2GeO3+3H2O.
(4)在50mL l mol•L-1的YX3溶液中逐滴加入0.5mol•L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积可能二种情况(填一或二).
| 原子或分子相关信息 | 单质及其化合物相关信息 | |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的$\frac{1}{2}$ | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(2)X的简单阴离子的结构示意图为
 ,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.
,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.(3)Z的氧化物在通讯领域用来作光导纤维,工业上制备Z的单质的化学反应方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应但在有H2O2 存在时可与NaOH 溶液反应生成锗酸盐,其方程式为Ge+2 H2O2+2NaOH=Na2GeO3+3H2O.
(4)在50mL l mol•L-1的YX3溶液中逐滴加入0.5mol•L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积可能二种情况(填一或二).

 .
. .
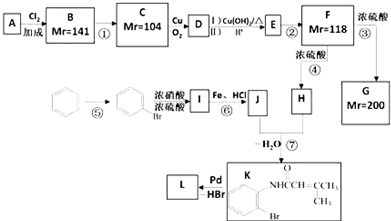
. )的合成路线:
)的合成路线: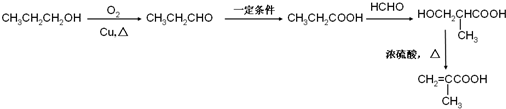 .
.
 .
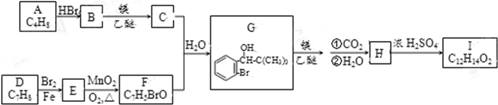
.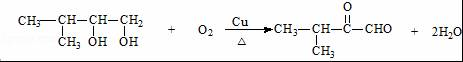 ;;F→G:
;;F→G: .
.
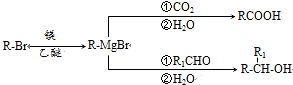
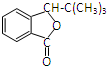 .
. .
.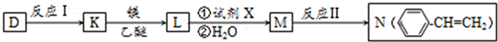
 .
.