题目内容
6.下列图示装置的实验中,操作正确且能达到实验目的是( )| A. |  如图:用食盐水制食盐晶体 | B. |  如图:分离碘酒中的碘和酒精 | ||
| C. |  如图:稀释浓硫酸 | D. | 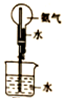 如图:验证氨水的碱性 |
分析 A.NaCl为可溶性固体,蒸发可分离;
B.碘和酒精不分层;
C.不能在容量瓶中稀释浓硫酸;
D.图中喷泉实验可检验氨气的溶解性.
解答 解:A.NaCl为可溶性固体,蒸发可分离,则图中蒸发装置可制食盐晶体,故A正确;
B.碘和酒精不分层,不能选图中分液装置分离,故B错误;
C.不能在容量瓶中稀释浓硫酸,应在烧杯中稀释,且将浓硫酸注入水,不断搅拌,故C错误;
D.图中喷泉实验可检验氨气的溶解性,与氨水的碱性无关,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的性质、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
1.下列关于Na2CO3和NaHCO3混合溶液的说法错误的是( )
| A. | 溶液中存在:[Na+]+[H+]=2[CO32-]+[HCO3-]+[OH-] | |
| B. | 若二者等物质的量混合,则溶液中[CO32-]=[HCO3-] | |
| C. | 该溶液中[H+]=Ka2[HCO3-]/[CO32-](Ka2为H2CO3的二级电离常数) | |
| D. | 该溶液加少量水稀释pH不发生明显变化 |
14.对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接与油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 向Mg(OH)2悬浊液中滴加CuSO4溶液,生成蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小,Mg(OH)2转化为Cu(OH)2 |
| D | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应会损失钾肥 |
| A. | A | B. | B | C. | C | D. | D |
1.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液:Ca2+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 水电离出的c(H+)=10-13mol•L-1的溶液中:K+、Na+、SO42-、ClO- | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
11.具有漂白作用的物质:①臭氧;②二氧化硫;③活性炭;④过氧化钠.其中漂白原理相同的是( )
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
18.25℃时,三种浓度均为0.1mol•L-1的溶液pH如下表,下列说法正确的是( )
| 序号 | ① | ② | ③ |
| 溶液 | NaClO | NaHCO3 | Na2CO3 |
| pH | 10.3 | 8.3 | 11.6 |
| A. | 酸性:HClO>H2CO3 | |
| B. | 由水电离产生的c(OH-):①>② | |
| C. | 溶液①中的c(ClO-)大于溶液②中的c(HCO3-) | |
| D. | 溶液③中:c(HCO3-)+c(CO32-)=0.1 mol•L-1 |
15.欲除去碳酸钠固体中混有的少量碳酸氢钠,最好的方法是( )
| A. | 将固体加热至不再有气体产生 | |
| B. | 将固体配成溶液,再加入过量的澄清石灰水 | |
| C. | 将固体配成溶液,再加入过量的NaOH溶液 | |
| D. | 将固体配成溶液,再通入足量的CO2气体 |
15.Cl2和SO2都具有漂白作用,能使品红溶液褪色.若将等物质的量的Cl2、SO2混合后,再通入品红溶液与BaCl2的混合溶液,能观察到的现象是( )
| A. | 溶液很快褪色,出现沉淀 | B. | 溶液不褪色,不出现沉淀 | ||
| C. | 溶液不褪色,出现沉淀 | D. | 溶液很快褪色,不出现沉淀 |