题目内容
2.下列有关化学反应表达正确的是( )| A. | 实验室用液溴和苯在催化剂作用下制溴苯: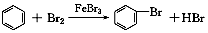 | |
| B. | 蛋壳溶于食醋:CaCO3+CH3COOH=CH3COOCa+H2O+CO2↑ | |
| C. | 甲醛溶液中加入足量新制碱性Cu(OH)2悬浊液并加热HCHO+2 Cu(OH)2+NaOH$\stackrel{△}{→}$ HCOONa+Cu2O↓+3H2O | |
| D. | 向氯乙烷水溶液中加入氢氧化钠溶液共热:CH3CH2Cl+NaOH $→_{△}^{水}$ CH2=CH2+NaCl+H2O |
分析 A.苯环上H被Br取代,发生取代反应制备溴苯;
B.生成醋酸钙,化学式为Ca(CH3COO)2;
C.反应生成碳酸钠;
D.加入氢氧化钠溶液共热,发生水解反应生成乙醇.
解答 解:A.实验室用液溴和苯在催化剂作用下制溴苯,发生取代反应为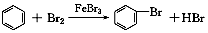 ,故A正确;
,故A正确;
B.蛋壳溶于食醋的反应为CaCO3+2CH3COOH=Ca(CH3COO)2+H2O+CO2↑,故B错误;
C.甲醛溶液中加入足量新制碱性Cu(OH)2悬浊液并加热的反应为HCHO+4Cu(OH)2+2NaOH$\stackrel{△}{→}$ Na2CO3+2Cu2O↓+6H2O,故C错误;
D.向氯乙烷水溶液中加入氢氧化钠溶液共热的水解反应为CH3CH2Cl+NaOH $→_{△}^{水}$ CH3CH2OH+NaCl,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应类型的判断,题目难度不大.

练习册系列答案
相关题目
18.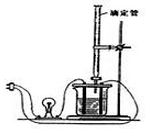 利用如图装置做下面的实验:在烧杯里盛半杯0.1mol/L乙溶液,然后用滴定管向容器里滴入0.1mol/L甲溶液.随着甲的滴入,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,电灯又会逐渐变暗.下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )
利用如图装置做下面的实验:在烧杯里盛半杯0.1mol/L乙溶液,然后用滴定管向容器里滴入0.1mol/L甲溶液.随着甲的滴入,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,电灯又会逐渐变暗.下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )
 利用如图装置做下面的实验:在烧杯里盛半杯0.1mol/L乙溶液,然后用滴定管向容器里滴入0.1mol/L甲溶液.随着甲的滴入,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,电灯又会逐渐变暗.下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )
利用如图装置做下面的实验:在烧杯里盛半杯0.1mol/L乙溶液,然后用滴定管向容器里滴入0.1mol/L甲溶液.随着甲的滴入,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,电灯又会逐渐变暗.下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )| A. | NH3•H2O、AgNO3 | B. | CH3COOH、NH3•H2O | C. | NaOH、AlCl3 | D. | H2SO4、Ba(OH)2 |
13.下列A-D四组,每组有两个反应,其中两个反应能用同一离子方程式表示的是:( )
| (Ⅰ) | (Ⅱ) | |
| A | 少量H2SO4滴入Ba(OH)2溶液中 | 少量NaHSO4滴入Ba(OH)2溶液中 |
| B | 少量NaOH滴入Al2(SO4)3溶液中 | 少量Al2(SO4)3溶液滴入氨水中 |
| C | FeO与足量的盐酸 | FeO与足量的稀硝酸 |
| D | 0.1mol Cl2通入含0.2mol FeBr2的溶液中 | 0.1mol Cl2通入含0.2mol FeCl2的溶液中 |
| A. | A | B. | B | C. | C | D. | D |
10.我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,下列操作正确的是( )
①将钢芯接在电池的正极上,②将镍接在电源的正极上,③在钢芯上发生的反应是:Ni2++2e-=Ni,④在镍上发生的反应是:4OH--4e-=O2+2H2O,⑤需用FeSO4溶液,⑥用NiSO4溶液作电解液.
①将钢芯接在电池的正极上,②将镍接在电源的正极上,③在钢芯上发生的反应是:Ni2++2e-=Ni,④在镍上发生的反应是:4OH--4e-=O2+2H2O,⑤需用FeSO4溶液,⑥用NiSO4溶液作电解液.
| A. | ①③⑥ | B. | ②③⑥ | C. | ①④⑤ | D. | ②③④⑥ |
7.从化学角度看,下列叙述正确的是( )
| A. | 海水晒盐属于化学变化 | B. | 电动车充电是化学能转变为电能 | ||
| C. | 不锈钢属于复合材料 | D. | 燃油以雾状喷出有利于完全燃烧 |
14.下列有关说法正确的是( )
| A. | CaCO3(s)═CaO(s)+CO2(g)在室温下不能自发进行,说明该反应的△H<0 | |
| B. | 焓变和熵变是判断反应方向的两个主要因素 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 | |
| D. | 任何情况下,温度都不可能对反应的方向起决定性作用 |
11.用NA表示阿伏伽德罗常数的值.下列叙述中不正确的是( )
| A. | 16.9g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA | |
| B. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目小于0.1 NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
12.关于有机物的性质,下列说法不正确的是( )
| A. | CH4气体能与Cl2在光照条件下发生取代反应生成CCl4 | |
| B. | CH2=CH2能使酸性高锰酸钾溶液褪色是因为发生了氧化反应 | |
| C. | 通常情况下,苯是无色气体,能在催化剂条件下与Br2发生单取代反应 | |
| D. | 乙醇和乙酯发生酯化反应生成乙酸乙酯是可逆反应 |
