题目内容
19.下列指定反应的离子方程式正确的是( )| A. | MgSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 0.3molFeBr2与0.4molCl2在溶液中反应:8Cl2+6Fe2++10Br-═6Fe3++16Cl-+5Br2 | |
| C. | Cu与稀HNO3反应:Cu+4H++2NO3-═Cu2++2NO↑+2H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O |
分析 A.漏掉镁离子与氢氧根离子的反应;
B.二价铁离子、溴离子都具有还原性,二价铁离子还原性强于溴离子,氯气先氧化二价铁离子,再氧化溴离子;
C.得失电子不守恒;
D.氯化银为沉淀,应保留化学式.
解答 解:A.MgSO4溶液与Ba(OH)2溶液混合,离子方程式:Mg2++2OH-+Ba2++SO42-═BaSO4↓+Mg(OH)2↓,故A错误;
B.0.3molFeBr2与0.4molCl2在溶液中反应,则三价铁离子全部被氧化,溴离子只有部分被氧化,离子方程式:8Cl2+6Fe2++10Br-═6Fe3++16Cl-+5Br2,故B正确;
C.Cu与稀HNO3反应,离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故C错误;
D.AgCl固体溶于足量氨水,离子方程式:AgCl+2NH3•H2O═[Ag(NH3)2]++2H2O+Cl-,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,侧重考查氧化还原反应、复分解反应的离子方程式书写,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循得失电子守恒,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.化合物Ⅰ和H2O2在一定条件下发生化学反应可使荧光剂发出绿蓝色的光,化合物Ⅰ和H2O2反应生成香草醛和另一种小分子物质,该小分子物质是( )


| A. | H2O | B. | O2 | C. | CO2 | D. | CO |
10.目前世界上60%的镁是从海水中提取的.主要步骤如下: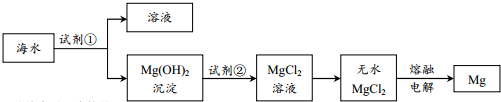
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 为使海水中的MgSO4转化成Mg(OH)2,试剂①可选择石灰乳 | |
| B. | 加入试剂①后,分离得到Mg(OH)2沉淀的方法是过滤 | |
| C. | 加入试剂②反应的离子方程式为:OH-+H+=H2O | |
| D. | 通过电解熔融的无水MgCl2得到48gMg,共转移4mol电子 |
7.常温下,下列有关溶液的说法正确的是( )
| A. | 向0.10mol•L-1NaHSO3溶液中通入NH3至溶液pH=7(通入气体对溶液体积的影响可忽略):c(Na+)>c(SO32-)>c(NH4+) | |
| B. | 0.1mol/L醋酸钠溶液20mL与0.1mol•L-1盐酸10mL混合后的溶液中:c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 已知Kw(HF)>Kw(CH3COOH),pH相等的NaF与CH3COOK两溶液中:c(Na+)-c(F-)>c(K+)-c(CH3COO-) | |
| D. | 0.1mol•L-1醋酸溶液和0.2mol•L-1醋酸钠溶液等体积混合后的溶液中:3c(H+)+2c(CH3COOH)=c(CH3COO-)+3c(OH-) |
14.为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间.
(1)设计实验2和实验3的目的是研究H2O2的浓度对化学反应速率的影响.
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4作对比(填序号).
(3)将实验1和实验2作对比,t1>t2(填“>”、“<”或“=”).
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-?2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1mol•L-1 KI溶液 ②0.1mol•L-1 FeCl3溶液 ③0.1mol•L-1 FeCl2溶液 ④0.1mol•L-1 盐酸 ⑤0.1mol•L-1KSCN溶液 ⑥CCl4
实验步骤:(1)取5mL 0.1mol•L-1 KI溶液,再滴加几滴0.1mol•L-1 FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂⑤(填序号),现象溶液显血红色,说明此反应存在一定的限度.
Ⅲ.N2O4可分解为NO2.在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2).c(NO2)随时间变化的数据记录如图所示.

(1)反应容器中最后剩余的物质有N2O4和NO2,其中N2O4的物质的量为0.004mol.
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后不变.
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间.
| 序号 | 反应 温度/℃ | c(H2O2)/ mol•L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4作对比(填序号).
(3)将实验1和实验2作对比,t1>t2(填“>”、“<”或“=”).
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-?2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1mol•L-1 KI溶液 ②0.1mol•L-1 FeCl3溶液 ③0.1mol•L-1 FeCl2溶液 ④0.1mol•L-1 盐酸 ⑤0.1mol•L-1KSCN溶液 ⑥CCl4
实验步骤:(1)取5mL 0.1mol•L-1 KI溶液,再滴加几滴0.1mol•L-1 FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂⑤(填序号),现象溶液显血红色,说明此反应存在一定的限度.
Ⅲ.N2O4可分解为NO2.在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2).c(NO2)随时间变化的数据记录如图所示.

(1)反应容器中最后剩余的物质有N2O4和NO2,其中N2O4的物质的量为0.004mol.
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后不变.
11.除去下列物质中的杂质(括号中为杂质),采用的试剂和除杂方法错误的是( )
| 选项 | 含杂质的物质 | 试剂 | 除杂方法 |
| A | CH4(C2H4) | Br2水 | 洗气 |
| B | C6H6(Br2) | Fe粉 | 蒸馏 |
| C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
| D | C2H2(H2S) | CuSO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
8.实验室用铅蓄电池作电源电解饱和食盐水制取Cl2,已知铅蓄电池放电时发生如下反应:负极:Pb+SO42--2e-═PbSO4正极:PbO2+4H++SO42-+2e-═PbSO4+2H2O今欲制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是( )
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.100 mol | D. | 0.20 mol |
7.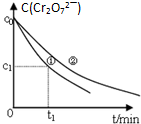 某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始c(H+)和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格).
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示.
(2)上述反应后草酸被氧化为CO2(填化学式).
(3)实验①和②的结果表明c(H+)越大,反应的速率越快;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1 (用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二:Al3+起催化作用;假设三:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
 某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始c(H+)和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格).
| 实验编号 | 初始c(H+) | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 1.0×10-4 | 60 | 10 | 30 |
| ② | 1.0×10-5 | 60 | 10 | 30 |
| ③ | 1.0×10-5 | 60 |
(2)上述反应后草酸被氧化为CO2(填化学式).
(3)实验①和②的结果表明c(H+)越大,反应的速率越快;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1 (用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二:Al3+起催化作用;假设三:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比试验. | 反应进行相同时间后,若溶液中的Cr2O72-浓度大于实验①中Cr2O72-浓度,则假设一成立;若两溶液中的Cr2O72-浓度相同,则假设一不成立. |
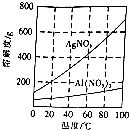 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下: