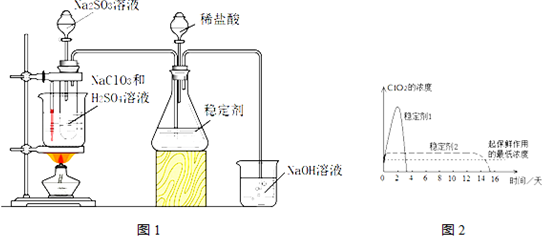
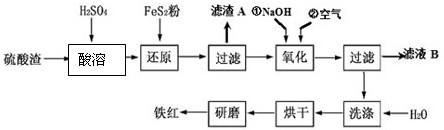
题目内容
将4.3gNa,Na2O,Na2O2的混合物与足量水反应,在标准状况下得到672ml混合气体将该混合气体通过放电恰好反应,则原混合物中Na、Na2O、Na2O2的物质的量之比
A.1:2:1 B.1:1:1 C.1:3:1 D.4:3:2
练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
10.乙二酸(COOH-COOH)与丁醇(C4H10O)在一定条件下反应,生成的二酯有( )
| A. | 4种 | B. | 6种 | C. | 8种 | D. | 10种 |



 pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是 气体,增大A的量,A、B的转化率都增大
气体,增大A的量,A、B的转化率都增大 2SO3(g);3Fe
2SO3(g);3Fe (s)+4H2O(g)
(s)+4H2O(g)
 数为______________。欲使起始反应维持向该方向进行,则x的最大值应小于____________。
数为______________。欲使起始反应维持向该方向进行,则x的最大值应小于____________。