题目内容
15.某温度时,VIA元素单质与H2反应生成气态H2X的热化学方程式如下:$\frac{1}{2}$O2(g)+H2(g)═H2O(g)△H=-242kJ•mol-1
S(g)+H2(g)═H2S(g)△H=-20kJ•mol-1
Se(g)+H2(g)?H2Se(g)△H=+81kJ•mol-1
下列说法正确的是( )
| A. | 稳定性:H2O<H2S<H2Se | |
| B. | 降温有利于Se与H2反应生成H2Se | |
| C. | O2(g)+2H2S(g)═2H2O(g)+2S(g)△H=-444 kJ•mol-1 | |
| D. | 随着核电荷数的增加,VIA族元素单质与H2的化合反应越容易发生 |
分析 A.相同物质的量的O2、S、Se三种物质,与氢气反应,生成物的能量越高,稳定性越差;
B.Se与H2反应为吸热反应,升高温度有利于反应进行;
C.根据已知方程式构建目标方程式,结合盖斯定律进行解答;
D.生成物的氢化物越稳定,其元素单质与H2的化合反应越容易.
解答 解:A.$\frac{1}{2}$O2(g)+H2(g)═H2O(g)△H=-242kJ•mol-1,O2(g)+2H2(g)═2H2O(g)△H=-484kJ•mol-1,相同物质的量的O2、S、Se三种物质,与氢气反应,O2释放的能量最多,Se需吸收能量,能量越高,稳定性越差,所以稳定性:H2O>H2S>H2Se,故A错误;
B.Se(g)+H2(g)?H2Se(g)△H=+81kJ•mol-1,该反应为吸热反应,升高温度有利于Se与H2反应生成H2Se,故B错误;
C.已知:①$\frac{1}{2}$O2(g)+H2(g)═H2O(g)△H=-242kJ•mol-1②S(g)+H2(g)═H2S(g)△H=-20kJ•mol-1,将①×2-②得O2(g)+2H2S(g)═2H2O(g)+2S(g)△H=-444 kJ•mol-1,故C正确;
D.由A选项分析可知稳定性:H2O>H2S>H2Se,生成物的氢化物越稳定,其元素单质与H2的化合反应越容易,所以随着核电荷数的增加,VIA族元素单质与H2的化合反应越难发生,故D错误;
故选C.
点评 本题考查了反应热的计算、元素周期律的应用,掌握盖斯定律的应用以及非金属性的递变规律是解答关键,题目难度中等.

练习册系列答案
相关题目
15.表列出了元素周期表中6种短周期元素的有关数据.
根据表中信息回答下列问题(均使用化学用语填空):
(1)写出下列编号对应元素的符号:②P,③Li.
(2)表中元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质反应生成的盐的化学式为NaClO4.
(3)请写出①、②、④三种元素的简单氢化物的稳定性由强到弱的顺序HF>NH3>PH3.
(4)元素⑥所在的主族中,氢化物的还原性最强的是HI.
(放射性元素除外)
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 原子半径(nm) | 0.075 | 0.110 | 0.152 | 0.071 | 0.186 | 0.099 |
| 最高价态 | +5 | +5 | +1 | 0 | +1 | +7 |
| 最低价态 | -3 | -3 | 0 | -1 | 0 | -1 |
(1)写出下列编号对应元素的符号:②P,③Li.
(2)表中元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质反应生成的盐的化学式为NaClO4.
(3)请写出①、②、④三种元素的简单氢化物的稳定性由强到弱的顺序HF>NH3>PH3.
(4)元素⑥所在的主族中,氢化物的还原性最强的是HI.
(放射性元素除外)
16.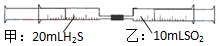 常温下,将甲针筒内20mLH2S推入含有10mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述错误的是(气体在同温同压下测定)( )
常温下,将甲针筒内20mLH2S推入含有10mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述错误的是(气体在同温同压下测定)( )
 常温下,将甲针筒内20mLH2S推入含有10mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述错误的是(气体在同温同压下测定)( )
常温下,将甲针筒内20mLH2S推入含有10mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述错误的是(气体在同温同压下测定)( )| A. | 有淡黄色固体生成 | B. | 有无色液体生成 | ||
| C. | 气体体积缩小 | D. | 最终约余15mL气体 |
3.某学生化学课外兴趣小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,进行了下列实验探究.
【提出假设】
假设1:沉淀为CuCO3;
假设2:沉淀为Cu(OH)2;
假设3:沉淀为碱式碳酸铜[化学式可表示为nCu(OH)2•mCuCO3].
【查阅资料】这三种沉淀受热均易分解,都生成黑色固体CuO.
【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:取一定量所得固体,用如图装置(夹持仪器未画)进行定性实验;
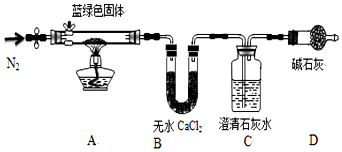
【问题讨论】
(1)假设2中的沉淀为Cu(OH)2,提出该假设的理论依据是碳酸根水解,溶液中含有较多的OH-
(2)步骤1用无水乙醇洗涤,再风干的目的利用乙醇的易挥发,带走洗涤的水;
(3)装置D装有碱石灰的干燥管所起的作用是利用乙醇的易挥发,带走洗涤的水
(4)若反应后A中蓝绿色固体变黑,C中澄清石灰水变浑浊,证明假设假设2(填写序号)一定不成立
(5)乙同学认为只要将图中B装置的试剂改用下列某试剂后,通过观察便可验证上述所有假设,该试剂是b(填代号)
a.浓硫酸 b.无水CuSO4 c.碱石灰 d.P2O5
(6)该小组经试验确定假设3成立,他们想进一步测定蓝绿色固体的化学式,丙同学查得一些物质在20℃的数据(如下表)后,建议将C中的澄清石灰水改为Ba(OH)2溶液,其原因是ac(双选,填代号)
a.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
b.Ba(OH)2为强碱,Ca(OH)2为弱碱
c.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
d.相同条件下,CaCO3的溶解度明显大于BaCO3
(7)作上述调整后,若所取蓝绿色固体质量为27.1g,实验结束后装置B中无水氯化钙的质量增加2.7g,C中氢氧化钡溶液里产生沉淀的质量为19.7g.则该蓝绿色固体的化学式为2CuCO3•3Cu(OH)2或3Cu(OH)2•2CuCO3或Cu5(OH)6(CO3)2.
【提出假设】
假设1:沉淀为CuCO3;
假设2:沉淀为Cu(OH)2;
假设3:沉淀为碱式碳酸铜[化学式可表示为nCu(OH)2•mCuCO3].
【查阅资料】这三种沉淀受热均易分解,都生成黑色固体CuO.
【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:取一定量所得固体,用如图装置(夹持仪器未画)进行定性实验;

【问题讨论】
(1)假设2中的沉淀为Cu(OH)2,提出该假设的理论依据是碳酸根水解,溶液中含有较多的OH-
(2)步骤1用无水乙醇洗涤,再风干的目的利用乙醇的易挥发,带走洗涤的水;
(3)装置D装有碱石灰的干燥管所起的作用是利用乙醇的易挥发,带走洗涤的水
(4)若反应后A中蓝绿色固体变黑,C中澄清石灰水变浑浊,证明假设假设2(填写序号)一定不成立
(5)乙同学认为只要将图中B装置的试剂改用下列某试剂后,通过观察便可验证上述所有假设,该试剂是b(填代号)
a.浓硫酸 b.无水CuSO4 c.碱石灰 d.P2O5
(6)该小组经试验确定假设3成立,他们想进一步测定蓝绿色固体的化学式,丙同学查得一些物质在20℃的数据(如下表)后,建议将C中的澄清石灰水改为Ba(OH)2溶液,其原因是ac(双选,填代号)
| 溶解度(s)/g | 溶度积(Ksp) | 摩尔质量(M)g/mol | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
b.Ba(OH)2为强碱,Ca(OH)2为弱碱
c.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
d.相同条件下,CaCO3的溶解度明显大于BaCO3
(7)作上述调整后,若所取蓝绿色固体质量为27.1g,实验结束后装置B中无水氯化钙的质量增加2.7g,C中氢氧化钡溶液里产生沉淀的质量为19.7g.则该蓝绿色固体的化学式为2CuCO3•3Cu(OH)2或3Cu(OH)2•2CuCO3或Cu5(OH)6(CO3)2.
10.甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景.
(1)已知:
CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316 kJ•mol-1.
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)?CH3OH(g),已知某些化学键的键能数据如表:
请回答下列问题
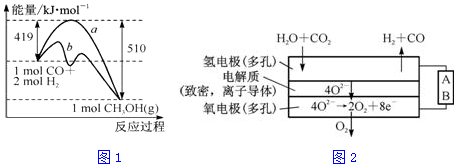
①该反应的△S<(填“>”或“<”)0.图1中曲线a到曲线b的措施是加入催化剂.
②已知CO中的C与O之间为三键,其键能为x kJ•mol-1,则x=1097.
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.①该电池负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
②若以该电池为电源,用石墨作电极电解200mL含有如表离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为3.2g.
(4)电解水蒸气和CO2产生合成气(H2+CO).较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2.由图2可知A为直流电源的负极(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:H2O+2e-=H2↑+O2-.
(1)已知:
CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316 kJ•mol-1.
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)?CH3OH(g),已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | x | 463 |

①该反应的△S<(填“>”或“<”)0.图1中曲线a到曲线b的措施是加入催化剂.
②已知CO中的C与O之间为三键,其键能为x kJ•mol-1,则x=1097.
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.①该电池负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
②若以该电池为电源,用石墨作电极电解200mL含有如表离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42 - |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
(4)电解水蒸气和CO2产生合成气(H2+CO).较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2.由图2可知A为直流电源的负极(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:H2O+2e-=H2↑+O2-.
4.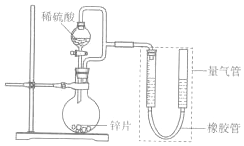 某同学设计计如图所示装罝(部分夹持装置己略去)进行实验探究:
某同学设计计如图所示装罝(部分夹持装置己略去)进行实验探究:
(1)用上述装置探究影响化学反应速率的因素.以生成9.0mL气体为计时终点,结果为t1>t2.
①比较实验I和Ⅱ可以得出的实验结论是在其他条件一定时,化学反应速率随反应物浓度的增大而增大.
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是BCD (填序号).
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀
①圆底烧瓶中的试剂可选用BD(填序号)
A.稀HCl B.NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是量气管右端液面下降,左端液面上升.
 某同学设计计如图所示装罝(部分夹持装置己略去)进行实验探究:
某同学设计计如图所示装罝(部分夹持装置己略去)进行实验探究:(1)用上述装置探究影响化学反应速率的因素.以生成9.0mL气体为计时终点,结果为t1>t2.
| 序号 | V(H2SO4)/mL | C(H2SO4)/mol•L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 4 | t2 |
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是BCD (填序号).
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀
①圆底烧瓶中的试剂可选用BD(填序号)
A.稀HCl B.NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是量气管右端液面下降,左端液面上升.
5.同主族元素形成的同一类型化合物,往往其结构和性质相似.PH4I是一种白色晶体,下列对PH4I的叙述中,正确的是( )
| A. | 它是一种共价化合物 | |
| B. | 它只含共价键 | |
| C. | 它不可能与NaOH溶液反应 | |
| D. | 它受热时,可能会分解产生有色气体 |
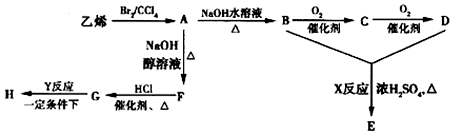
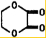 +2H2O;
+2H2O;