��Ŀ����
17��������ijͬѧ��ʵ�����ж�SO2���Ʊ�������ʵ���̽�����̣��ش��������⣺��1��ѡȡʵ��װ����ͼ1���Լ���
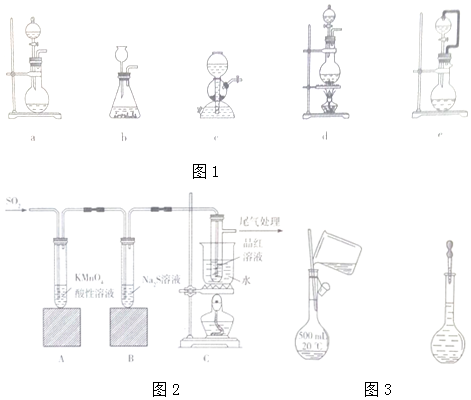
�ٲ���Na2SO3�����ᷴӦ��ȡSO2����ѡ��װ��ae�����ţ���ͬ������ʹ��Ӧ��ƽ�����У�����˳�����ٵ��£���ѡ��װ��e��
�ڲ���Na2SO3�����ᷴӦ��ȡS02��ѡ�õ��������ΪC��
A���������� B.98%������C.85%������ D.20%������
��2������ʵ��̽����
��֪����ͼ2װ��B���е���ɫ�������ɣ�
��ͨ��SO3��װ��A���Թ��ڵ�ʵ�����������Ը��������Һ��ɫ��
��װ��C����֤SO2��Ʒ�����ɲ��ȶ������ʣ����������������ǵ�ȼ�ƾ��ƣ����ȣ��Թ���Ʒ����Һ�ָ�Ϊ��ɫ��
����֤SO2�����Ե�װ����B���A����B����C��������Ӧ�Ļ�ѧ����ʽ��SO2+2Na2S+2H2O=4NaOH+3S��
��3��ʵ��ʱ��Ҫ10moL•L-1��NaOH��Һ����SO2β����
��NaOH��Һ����SO2β�������ӷ���ʽ��2OH-+SO2=SO32-+H2O��
��ͼ3������250mL10mo L•L-1 NaOH��Һʱ�������������裬д��ͼ�д��ڵĴ�����ѡ��500mL����ƿ������ʱ����ͷ�ιܲ�����������ƿ��_��
���� ��1���ٸ��ݷ�Ӧ���״̬�ͷ�Ӧ����ѡ��װ�ã�
��Ϊ���ڶ��������������Ӧѡ��Ũ���ᣬ��Ũ�ȹ��ߣ����Ტδ��ȫ���룬���Է�����ʽ���ڣ���Na2SO3��H2SO4�ķ�Ӧ����H2SO4��������ӵ�״̬�²���˳�����еģ���ͨ������80%��ŨH2SO4��
��2�����������л�ԭ�ԡ������Ժ�Ư���ԣ�ͨ��ʢ�����Ը�����ص�Aװ�ã������������Ը��������ɫ��ͨ��ʢ��������Һ��Bװ�ã�������̬���з�Ӧ���ɵ���ɫ��S���ʣ�ͨ��ʢ��Ʒ����Һ��Cװ�ã�ʹƷ����Һ��ɫ�����ȣ���ɫ�ָ����ݴ˷�����
��3����NaOH��SO2��Ӧ�����������ƣ�
������250mL��Һѡ��250mL����ƿ����ͷ�ιܲ�����������ƿ�ڣ�������Ⱦ��Һ��
��� �⣺��1����Na2SO3�����ᷴӦ��ȡSO2��Ϊ��Һ�������ͣ�ae���ɣ���ѹ©����Ӧ��ƽ�����У�����˳�����ٵ��£�
�ʴ�Ϊ��ae��e��
��Ϊ���ڶ��������������Ӧѡ��Ũ���ᣬ��Ũ�ȹ��ߣ����Ტδ��ȫ���룬���Է�����ʽ���ڣ���Na2SO3��H2SO4�ķ�Ӧ����H2SO4��������ӵ�״̬�²���˳�����еģ���ͨ������80%��ŨH2SO4��
�ʴ�Ϊ��C��
��2���ٶ��������л�ԭ�ԣ�ʹ���Ը��������ɫ��
�ʴ�Ϊ�����Ը��������Һ��ɫ��
�ڶ���������Ư���ԣ�ʹƷ����Һ��ɫ����SO2��Ʒ�����ɲ��ȶ������ʣ����ȣ�Ʒ����ɫ�ָ�������������������ǣ���ȼ�ƾ��ƣ����ȣ��Թ���Ʒ����Һ�ָ�Ϊ��ɫ��
�ʴ�Ϊ����ȼ�ƾ��ƣ����ȣ��Թ���Ʒ����Һ�ָ�Ϊ��ɫ��
����֤SO2�����Ե�װ����B�������������������̬���з�Ӧ���ɵ���ɫ��S���ʣ���ѧ����ʽΪ��SO2+2Na2S+2H2O=4NaOH+3S����
�ʴ�Ϊ��B��SO2+2Na2S+2H2O=4NaOH+3S����
��3����NaOH��Һ����SO2β�������ӷ���ʽ�ǣ�2OH-+SO2=SO32-+H2O��
�ʴ�Ϊ��2OH-+SO2=SO32-+H2O��
������250mL��Һѡ��250mL����ƿ����ͷ�ιܲ�����������ƿ�ڣ�������Ⱦ��Һ��
�ʴ�Ϊ������ѡ��500mL����ƿ������ʱ����ͷ�ιܲ�����������ƿ�ڣ�
���� ���⿼���˶���������Ʊ����漰ʵ��װ�õ�ѡ�����ʵ����ʡ����ӷ���ʽ����д��֪ʶ�㣬��Ŀ�Ѷ��еȣ��������ʵ����ʲ���������ǹؼ���

̽��һ��̽���������������������绯ѧ��ʴ���͵�Ӱ�����أ�����Ͼ��ȵ��������ۺ�̿��������ƿ�ײ�������ƿ������ͼ��ʾ�����ӽ�ͷ�ι��е��뼸�δ�����Һ��ͬʱ���������е�ѹǿ�仯��

��1�����������ʵ����Ʊ������в�Ҫ���ո�
| ��� | ʵ��Ŀ�� | ̼��/g | ����/g | ����/% |
| �� | Ϊ����ʵ�������� | 0.5 | 2.5 | 90.0 |
| �� | �� | 0.5 | 2.5 | 36.0 |
| �� | ̼��������Ӱ�� | 0.2 | �� | 90.0 |
��3����С���ͼ��2����0��t1ʱѹǿ����ԭ����������¼��裬������ɼ������
����һ���������ⸯʴ���������壻
���������Ӧ����ʹ��ƿ���¶����ߣ�
̽������̽���������
����ͼ2װ�������50mL 0.5mol•L-1CuCl2��Һ��ʵ�飮
ʵ���¼��
A���������л���ɫ���������������ʹʪ��ĵ��۵⻯����ֽ�ȱ�������ɫ����ʾ��Cl2�����Դ���IO3-����
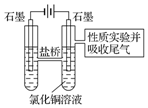
B�����һ��ʱ���Ժ������������ͭ�����⣬���������������ݺ�dz��ɫ���壮
��4��������ʵ���¼A����ֽ��ɫ�仯�������ӷ���ʽ���ͣ�
��2I-+Cl2=I2+2Cl-��
��5Cl2+I2+6H2O=10Cl-+2IO3-+12H+��
��5������ʵ���¼B��dz��ɫ���������Cu��OH��2��д��ѧʽ�����Է������ɸ����ʵ�ԭ���ñ�Ҫ�����ֺͻ�ѧ������ͣ����ϳ�ʱ���ͭ����Ũ���½��������ӿ�ʼ�ŵ磬��Һ��PH����ͭ����ת��Ϊ������ͭ������
��CuS����FeS����Al2S3����Fe2S3����Cu2S����FeCl2 ��H2S�� ��FeCl3��
| A�� | �ڢۢݢߢ� | B�� | �٢ܢޢ� | C�� | �٢ڢۢߢ� | D�� | �ڢۢݢޢߢ� |
| A�� | Na2CO3+H2SO4�TCO2��+H2O+Na2SO4 | B�� | CO2+2NaOH�TNa2CO3+H2O | ||
| C�� | CO2+2Mg$\frac{\underline{\;��ȼ\;}}{\;}$ 2MgO+C | D�� | CO2+Na2O=Na2CO3 |
| A�� | ������һ����ͭ | |
| B�� | ������һ������ | |
| C�� | ��������һ����ͭ������һ������ | |
| D�� | ��Һ��һ������FeSO4��һ��û��CuSO4 |
| A�� | ��С | B�� | ��� | C�� | ���� | D�� | ��ȷ�� |
| A�� | C+O2$\stackrel{��ȼ}{��}$CO2 | B�� | C��s��+O2��g��$\stackrel{��ȼ}{��}$CO2��g��+393.5kJ | ||
| C�� | C��s��+O2��g��$\stackrel{��ȼ}{��}$CO2��g�� | D�� | C��s��+O2��g��=CO2��g��+393.5kJ |
 ijͬѧͨ��ʵ���о��Ƽ��仯������й����ʣ���ش�������⣮
ijͬѧͨ��ʵ���о��Ƽ��仯������й����ʣ���ش�������⣮