题目内容
4.下列装置应用于实验室进行相关实验,能达到实验目的是( )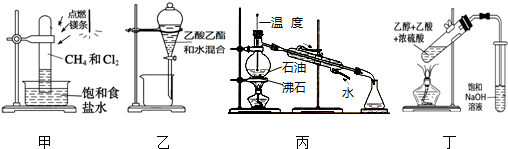
| A. | 用装置甲在强光照条件下制取一氯甲烷 | |
| B. | 用装置乙分离乙酸乙酯和水 | |
| C. | 用装置丙蒸馏石油并收集60~150℃馏分 | |
| D. | 用装置丁制取并收集乙酸乙酯 |
分析 A.甲烷与氯气的取代反应为链锁反应,产物复杂;
B.乙酸乙酯和水分层;
C.温度计测定馏分的温度,冷却水下进上出;
D.乙酸乙酯、乙酸均与NaOH反应.
解答 解:A.甲烷与氯气的取代反应为链锁反应,产物复杂,不能利用光照下取代反应制备氯乙烷,故A错误;
B.乙酸乙酯和水分层,利用图中分液漏斗可分离,故B正确;
C.温度计测定馏分的温度,冷却水下进上出,则温度计水银球应在烧瓶支管口处,故C错误;
D.乙酸乙酯、乙酸均与NaOH反应,小试管中应为饱和碳酸钠溶液,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
14.短周期元素A、B、C的原子序数依次增大,其原子的最外层电子数中和为10,A与C在周期表中位于同一族,B原子最外层电子数等于A原子次外层电子数,下列有关叙述不正确的是( )
| A. | A与C可形成共价化合物 | |
| B. | A的简单氢化物的稳定性大于C的简单氢化物的稳定性 | |
| C. | 原子半径:A<B<C | |
| D. | B的氧化物的熔点比A的最高价氧化物熔点高 |
15.在烧瓶中完成反应:2NaX+H2SO4(浓)$\stackrel{△}{→}$Na2SO4+2HX↑.则HX可以是( )
| A. | HNO3 | B. | HCl | C. | HBr | D. | HF |
12.只用胶头滴管和试管通过两试剂的互滴,能区别的下列溶液( )
| A. | NaAlO2和KOH | B. | NaHCO3和Ca(OH)2 | C. | AlCl3和氨水 | D. | HCl和Na2CO3 |
9.次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.NaH2PO2为正盐,可将溶液中的Ag+还原为Ag,从而可用于化学镀银.利用NaH2PO2进行化学镀银反应中,若氧化剂与还原剂的物质的量之比为4:1,则氧化产物的化学式为( )
| A. | H3PO4 | B. | Na3PO4 | C. | Ag | D. | Na2HPO2 |
13.短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法中正确的是( )
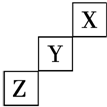

| A. | Z可能是活泼金属元素 | |
| B. | X的最高价氧化物对应的水化物是一种强酸 | |
| C. | Y元素原子的最外层电子数为7 | |
| D. | Z的最高价氧化物对应水化物的化学式为H2ZO4 |
14.短周期主族元素X、Y、Z、W的原子序数依次增大,四种元素同周期;X的金属性在同周期元素中最强;Y原子的电子层数与最外层电子数相等;Z元素在地壳中的含量居于第二位;W的最高价氧化物的水化物的化学式为HnWO2n+2,下列说法正确的是( )
| A. | 简单离子半径:X<Y<W | |
| B. | Y、Z两种元素的氧化物均具有两性 | |
| C. | Z、W形成化合物的电子式为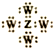 | |
| D. | X、W分别形成的氢化物中所含化学键种类相同 |