题目内容
19.向含有 Mg2+、Fe2+、Fe3+、Al3+的溶液中,加入过量的 NaOH 溶液,搅拌,再加入过量盐酸,原溶液中阳离子的物质的量减少的是( )| A. | Fe2+ | B. | Mg2+ | C. | Fe3+ | D. | Al3+ |
分析 加入过量的氢氧化钠溶液并充分搅拌,Mg2+、Fe2+、Fe3+离子均转化为沉淀,Al3+转化为偏铝酸根离子,氢氧化亚铁被氧化为氢氧化铁,结合再加入过量的盐酸发生反应Mg(OH)2+2H+=2H2O+Mg2+、Cu(OH)2+2H+=2H2O+Cu2+、Fe(OH)3+3H+=3H2O+Fe3+、AlO2-+4H+=Al3++2H2O,根据发生反应分析原溶液中物质的量减少的离子.
解答 解:溶液中有Fe2+、Fe3+、Mg2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液并充分搅拌,发生反应为:Mg2++2OH-=Mg(OH)2↓、Cu2++2OH-=Cu(OH)2↓、Fe2++2OH-=Fe(OH)2↓、Al3++4OH-=AlO2-+2H2O,Mg2+、Fe2+、Fe3+离子均转化为沉淀,Al3+转化为AlO2-,
氢氧化亚铁被氧化为氢氧化铁:4Fe(OH)2+2H2O+O2═4Fe(OH)3,
再加入过量的盐酸,发生反应为:Mg(OH)2+2H+=2H2O+Mg2+、Cu(OH)2+2H+=2H2O+Cu2+、Fe(OH)3+3H+=3H2O+Fe3+、AlO2-+4H+=Al3++2H2O,氢氧化铁、氢氧化镁、偏铝酸钠与盐酸反应生成金属阳离子为Fe3+、Mg2+和Al3+,显然溶液中大量减少的离子是Fe2+,
故选A.
点评 本题考查离子共存的知识,为高考常见题型,题目难度不大,侧重复分解反应的考查,把握发生的化学反应为解答的关键,注意氢氧化铝的两性、氧化还原反应即可解答,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
9.下列各组离子在给定条件下能大量共存的是( )
| A. | 在c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、S2-、AlO2-、SO32- | |
| B. | pH<7的溶液中:SO42-、CO32-、Na+、K+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- |
10.下列关于物质的性质或用途的说法正确的是( )
| A. | 乙烯可使溴的四氯化碳溶液褪色 | B. | 乙醇难溶于水,密度比水小 | ||
| C. | 氧化镁用于电解冶炼单质镁 | D. | 二氧化硅用于制造太阳能电池 |
7.联合国卫生组织经过考察和研究,认为我国使用的铁锅是有益于人类健康的理想炊具,并向全世界推广,其主要原因是( )
| A. | 价格便宜,不易生锈 | |
| B. | 铁锅只含有铁元素 | |
| C. | 烹调的食物中留有人体需要的铁元素 | |
| D. | 传热慢,保温性能好 |
14.只用一种试剂,将分别含有 Fe3+、Al3+、Mg2+、NH4+等阳离子的四种溶液区分开,这种试剂是( )
| A. | NaOH 溶液 | B. | NaCl 溶液 | C. | KSCN 溶液 | D. | 氨水 |
4.下列各种反应类型中,后者一定包含前者的是( )
| A. | 分解复分解 | B. | 氧化化合 | C. | 复分解中和 | D. | 置换氧化还原 |
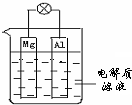 如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):