题目内容
14.向盛有硫酸锌水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到透明溶液.下列对此现象说法不正确的是( )| A. | 用硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样的现象 | |
| B. | 沉淀溶解后,将生成配合离子[Zn(NH3)4]2+ | |
| C. | 反应后溶液中不存在任何沉淀,所以反应前后Zn2+的浓度不变 | |
| D. | 在[Zn(NH3)4]2+离子中,NH3给出孤对电子,Zn2+提供空轨道 |
分析 向硫酸锌溶液中加入氨水,氨水先和硫酸锌反应生成氢氧化锌沉淀,继续添加氨水,氨水和氢氧化锌反应生成可溶性的锌氨络合物.
A.硝酸锌中的锌离子和氨水反应现象与硫酸锌中锌离子和氨水反应现象相同,硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样现象;
B.氢氧化锌和氨水反应生成配合物而使溶液澄清;
C.硫酸锌先和氨水反应生成氢氧化锌,氢氧化锌和氨水反应生成络合物;
D.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键.
解答 解:A.硝酸锌中的锌离子和氨水反应与硫酸锌中锌离子和氨水反应本质一样,所以现象相同,即硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样现象,故A正确;
B.硫酸锌和氨水反应生成氢氧化锌沉淀,继续加氨水时,氢氧化锌和氨水继续反应生成络合物离子[Zn(NH3)4]2+而使溶液澄清,故B正确;
C.硫酸锌和氨水反应生成氢氧化锌沉淀,继续加氨水时,氢氧化锌和氨水继续反应生成络合物而使溶液澄清,所以溶液中锌离子浓度减小,故C错误;
D.在[Zn(NH3)4]2+离子中,Zn2+提供空轨道,NH3提供孤电子对,故D正确;
故选C.
点评 本题考查了配合物、配位键的形成等性质,难度不大,明确形成配合物的条件是:有提供空轨道的中心原子,有提供孤电子对的配位体.

练习册系列答案
相关题目
2.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
| A. | NaOH固体 | B. | NH4Cl固体 | C. | NaNO3固体 | D. | CH3COONa固体 |
9.下列有机物的命名正确的是( )
| A. | 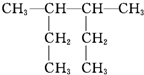 3-甲基-2-乙基戊烷 3-甲基-2-乙基戊烷 | |
| B. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| C. | 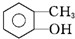 邻甲基苯酚 邻甲基苯酚 | |
| D. | 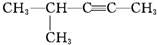 2-甲基-3-戊炔 2-甲基-3-戊炔 |
19.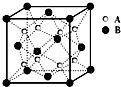 某晶体中晶体结构最小的重复单元如图:A在正方体内,B分别在顶点和面心,则该晶体的化学式为( )
某晶体中晶体结构最小的重复单元如图:A在正方体内,B分别在顶点和面心,则该晶体的化学式为( )
 某晶体中晶体结构最小的重复单元如图:A在正方体内,B分别在顶点和面心,则该晶体的化学式为( )
某晶体中晶体结构最小的重复单元如图:A在正方体内,B分别在顶点和面心,则该晶体的化学式为( )| A. | B2A | B. | BA2 | C. | B7A4 | D. | B4A7 |
4.化学反应速率受条件的影响很大,下列肯定可以加快化学反应速率的措施是( )
| A. | 使用催化剂 | B. | 改变浓度 | C. | 升高温度 | D. | 降低温度 |
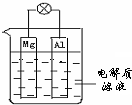 如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):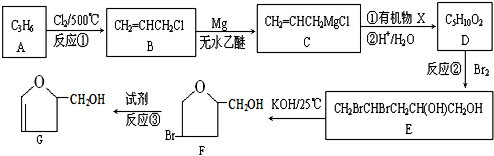

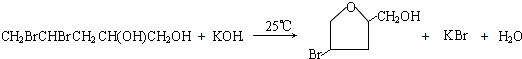 ;
;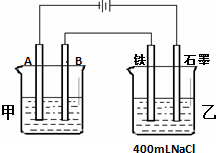 如图所示为相互串联的甲、乙两个电解池,试回答:
如图所示为相互串联的甲、乙两个电解池,试回答: