题目内容
现有7种短周期元素的性质或原子结构如下表:
完成下列空白(涉及W、U、R、T、X、Y、Z代表的元素时,用相应的元素符号表示):
(1)元素T的原子核外共有 个电子;元素X的一种核素其中子数比质子数多2,这种核素的符号是 .
(2)用离子方程式表示:
①元素Y与元素W形成的离子YW4+与NaOH溶液共热
②元素U的单质与NaOH溶液反应: .
(3)元素Z与元素T相比,非金属性较强的是 ,下列表述中能证明这一事实的是 (填字母).
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异是学习的重要方法之一.在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是 (用分子式表示),理由是 .
| 元素编号 | 元素性质或原子结构 |
| W | 周期表中原子半径最小的元素 |
| U | 地壳中含量最多的金属元素 |
| R | 单质占空气体积的1/5 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子核外共有
(2)用离子方程式表示:
①元素Y与元素W形成的离子YW4+与NaOH溶液共热
②元素U的单质与NaOH溶液反应:
(3)元素Z与元素T相比,非金属性较强的是
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异是学习的重要方法之一.在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:W是周期表中原子半径最小的元素,故W为氢;地壳中含量最多的金属元素为铝,故U为铝;单质占空气体积的1/5,即R为氧;T层上有6个电子,故T为硫;最外层电子数是次外层电子数的2倍,故X为碳;氢化物水溶液呈碱性,故Y为氮;元素最高正价是+7价,故Z为氯,据此解答各小题即可.
解答:
解:W是周期表中原子半径最小的元素,故W为氢;地壳中含量最多的金属元素为铝,故U为铝;单质占空气体积的1/5,即R为氧;T层上有6个电子,故T为硫;最外层电子数是次外层电子数的2倍,故X为碳;氢化物水溶液呈碱性,故Y为氮;元素最高正价是+7价,故Z为氯,
(1)元素T为硫,S的原子核外共有16个电子,元素C的一种核素其中子数比质子数多2,这种核素的符号为 ,故答案为:16;
,故答案为:16; ;
;
(2)①元素N与元素H形成的离子NH4+与NaOH溶液共热反应生成氨气和水,离子反应方程式为:NH4++OH-
NH3↑+H2O;②元素Al的单质与NaOH溶液反应生成偏铝酸钠和氢气,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:NH4++OH-
NH3↑+H2O;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)元素Cl与元素S相比,非金属性较强的是Cl,
a.常温下Z的单质和T的单质状态不同
,状态与非金属性无关,故a错误;
b.Z的氢化物比T的氢化物稳定,气态氢化物越稳定,说明非金属性越强,故b正确;
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应,都能反应,不能说明强弱,故c错误,故选b,
故答案为:Cl;b;
(4)T、X、Y、Z四种元素的最高价氧化物对应水化物分别为H2SO4、H2CO3、HNO3、HClO4,H2CO3是弱酸,其余均为强酸,
故答案为:H2CO3;H2CO3是弱酸,其余均为强酸.
(1)元素T为硫,S的原子核外共有16个电子,元素C的一种核素其中子数比质子数多2,这种核素的符号为
 ,故答案为:16;
,故答案为:16; ;
;(2)①元素N与元素H形成的离子NH4+与NaOH溶液共热反应生成氨气和水,离子反应方程式为:NH4++OH-
| ||
| ||
(3)元素Cl与元素S相比,非金属性较强的是Cl,
a.常温下Z的单质和T的单质状态不同
,状态与非金属性无关,故a错误;
b.Z的氢化物比T的氢化物稳定,气态氢化物越稳定,说明非金属性越强,故b正确;
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应,都能反应,不能说明强弱,故c错误,故选b,
故答案为:Cl;b;
(4)T、X、Y、Z四种元素的最高价氧化物对应水化物分别为H2SO4、H2CO3、HNO3、HClO4,H2CO3是弱酸,其余均为强酸,
故答案为:H2CO3;H2CO3是弱酸,其余均为强酸.
点评:本题考查结构性质位置关系、核外电子排布规律、元素周期律等,难度不大,推断元素是解题关键,注意基础知识的理解掌握.

练习册系列答案
相关题目
下列物质的沸点由高到低的排列正确的是( )
①丙烷②乙二醇③乙醇④丁烷⑤乙烷⑥2-甲基丙烷.
①丙烷②乙二醇③乙醇④丁烷⑤乙烷⑥2-甲基丙烷.
| A、②③⑥④①⑤ |
| B、②③④⑥①⑤ |
| C、④⑥①②③⑤ |
| D、④①③⑥②⑤ |
2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行.能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是( )
| A、加入水中,浮在水面上的是地沟油 |
| B、测定沸点,有固定沸点的是矿物油 |
| C、加入足量氢氧化钠溶液共热,不分层的是地沟油 |
| D、点燃,能燃烧的是矿物油 |
下列物质中互为同系物的是( )
| A、葡萄糖和果糖 |
| B、蔗糖和麦芽糖 |
| C、乙酸和丙酸(CH3CH2COOH) |
D、乙醇和甘油( ) ) |
有100mL 3mol?LNaOH溶液和100mL 1mol?L-1 AlCl3溶液.按如下两种方法进行实验:①将氢氧化钠溶液分多次加到AlCl3溶液中;②将AlCl3溶液分多次加到NaOH溶液中.比较两次实验的结果是( )
| A、现象相同,沉淀量相等 |
| B、现象不同,沉淀量不等 |
| C、现象相同,沉淀量不等 |
| D、现象不同,沉淀量相等 |
已知X、Y是主族元素,I为电离能,单位是kJ?mol-1.请根据下表所列数据判断,下列说法错误的是( )
| 元素 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A、若元素Y处于第三周期,则它可与冷水剧烈反应 |
| B、元素Y是第ⅢA族元素 |
| C、元素X与氯形成化合物时,化学式可能是XCl |
| D、元素X的常见化合价是+1价 |
用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉.对加入铁粉充分反应后的分析合理的是( )
| A、若溶液中有Fe3+,则一定有Cu析出 |
| B、若溶液中只含Fe2+、Cu2+,则固体可能存在 |
| C、若有固体析出,则溶液中一定没有Cu2+ |
| D、若溶液中只有Fe2+,则固体一定只含Cu |
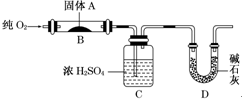 实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出)H:1 O:16 C:12
实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出)H:1 O:16 C:12