题目内容
12.下列说法中正确的是( )| A. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| B. | Al、Fe、Cu的单质放置在空气中均只生成氧化物 | |
| C. | SiO2与酸、碱均不反应 | |
| D. | 向一定浓度的Na2SiO3溶液中通入适量CO2气体,出现白色沉淀,则H2SiO3的酸性比H2CO3的酸性强 |
分析 A.随着反应的进行,硝酸浓度降低;
B.铜可被氧化生成碱式碳酸铜;
C.二氧化硅与HF、强碱溶液反应;
D.硅酸的酸性比碳酸弱.
解答 解:A.随着反应的进行,硝酸浓度降低,稀硝酸与铜反应生成NO气体,故A正确;
B.铜在空气中生锈,可被氧化生成碱式碳酸铜,故B错误;
C.二氧化硅与HF、强碱溶液反应,故C错误;
D.应符合强酸制备弱酸的特定,硅酸的酸性比碳酸弱,故D错误.
故选A.
点评 本题考查较为综合,涉及铜、硝酸、二氧化硅等知识,为高频考点,侧重于学生的双基知识的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
3.下列有关电解质溶液的说法正确的是( )
| A. | 常温下分别测等体积、等浓度的醋酸和氨水pH,发现二者的pH 之和为14,说明常温下醋酸和氨水的电离平衡常数相等 | |
| B. | 将CH3COONa溶液从25℃升温至 40℃,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| C. | 向硝酸中加入氨水至中性,溶液中$\frac{{c(N{H_4}^+)}}{{c(N{O_3}^-)}}$<1 | |
| D. | 向AgCl、AgBr 的饱和溶液中加入少量 AgNO3,溶液中$\frac{c(C{l}^{-})}{c(B{r}^{-})}$增大 |
7.下列实验中,对应的现象以及实验目的都正确的是( )
| 选项 | 目的 | 实验 | 现象 |
| A | 检验CO2气体中混有SO2 | 将气体通入盛有足量的澄清石灰水中的洗气瓶中 | 石灰水变浑浊 |
| B | 检验黑色固体Fe3O4中含有+3价铁元素 | 将少量黑色固体加入盛有KSCN溶液的烧杯中 | 固体溶解,溶液呈血红色 |
| C | 比较氯和碳的非金属性强弱 | 将碳酸钠溶液中滴入稀盐酸 | 有气泡产生 |
| D | 验证氧化性:Fe3+>Cu2+ | 将一定量铜粉加到盛有一定体积的1.0mol•L-1Fe2(SO4)3溶液的试管中 | 铜粉溶解,溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
16. 氨在化肥生产、制冷、“贮氢”及燃煤烟气脱硝脱硫等领域用途非常广泛.
氨在化肥生产、制冷、“贮氢”及燃煤烟气脱硝脱硫等领域用途非常广泛.
(1)尿素[OC(NH2)2]与氰酸铵(NH4CNO)互为同分异构体;氰酸铵属于离子 (选填“离子”或“共价”)化合物.
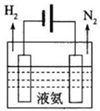
(2)液氨是一种重要的制冷剂,制冷过程中气态氨转变为液氨将释放 (选填“吸收”或“释放“)能童.液氨也是一种“贮氢”材料,液氨可通过如图装置释放氢气,该过程中能童转化方式为电能转化为化学能.
(3)已知拆开1mol气态物质中某种共价键需要吸收的能星就是该共价键的键能,某些共价键的键能见下表:
则合成氨反应:N2(g)+3H2(g) 2NH3(g)△H=-90.8kJ•mol-1.
(4)氨气可作为脱硝剂.在恒温恒容密闭荇器中充入NO和NH3,在一定条件下发生了反 应:6NO(g)+4NH3(g)=5N2(g)+6H2O(g).已知反应开始时NO的物质的量浓度是1.2mol•L-1,2min后,NH3的物质的量浓度从开始的1.0mol•L-1降到 0.8mol•L-1,则
①2min末NO的物质的量浓度为0.9mol/L.
②这2min内N2的平均反应速率为0.125mol/(L•min).
(5)工业上用氨水吸收硫酸工业尾气中的SO2,既可消除污染又可获得NH4HSO3等产品. 若用1000kg含NH3质量分数为17%的氨水吸收SO2且全部转化为NH4HSO3,不考虑其它成本,则可获得的利润为782元(参照下面的价格表).
 氨在化肥生产、制冷、“贮氢”及燃煤烟气脱硝脱硫等领域用途非常广泛.
氨在化肥生产、制冷、“贮氢”及燃煤烟气脱硝脱硫等领域用途非常广泛.(1)尿素[OC(NH2)2]与氰酸铵(NH4CNO)互为同分异构体;氰酸铵属于离子 (选填“离子”或“共价”)化合物.
(2)液氨是一种重要的制冷剂,制冷过程中气态氨转变为液氨将释放 (选填“吸收”或“释放“)能童.液氨也是一种“贮氢”材料,液氨可通过如图装置释放氢气,该过程中能童转化方式为电能转化为化学能.
(3)已知拆开1mol气态物质中某种共价键需要吸收的能星就是该共价键的键能,某些共价键的键能见下表:
| 共价键 | H-H | N-H | N=N |
| 键能/kJ•mol-1 | 436 | 390.8 | 946 |
(4)氨气可作为脱硝剂.在恒温恒容密闭荇器中充入NO和NH3,在一定条件下发生了反 应:6NO(g)+4NH3(g)=5N2(g)+6H2O(g).已知反应开始时NO的物质的量浓度是1.2mol•L-1,2min后,NH3的物质的量浓度从开始的1.0mol•L-1降到 0.8mol•L-1,则
①2min末NO的物质的量浓度为0.9mol/L.
②这2min内N2的平均反应速率为0.125mol/(L•min).
(5)工业上用氨水吸收硫酸工业尾气中的SO2,既可消除污染又可获得NH4HSO3等产品. 若用1000kg含NH3质量分数为17%的氨水吸收SO2且全部转化为NH4HSO3,不考虑其它成本,则可获得的利润为782元(参照下面的价格表).
| NH3质量分数17%的氨水 | 无水 NH4HSO3 | |
| 价格(元/kg) | 1.0 | 1.8 |