题目内容
2.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.I.已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)△H=-825.5kJ/mol
则反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=23.5kJ/mol.
II.反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
III.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图1示回答下列问题:
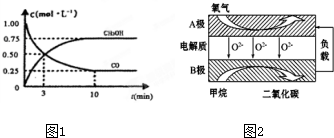
(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(4)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向正(填“正”、“逆”)反应方向移动.
(5)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图2.回答下列问题:
①B极上的电极反应式为CH4-8e-+402-=CO2+2H2O.
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的体积为5.6L(标准状况下).
分析 I.已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
②2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)△H=-825.5kJ/mol
则依据盖斯定律计算①×$\frac{3}{2}$-②得到反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)的热化学方程式得到反应的焓变;
Ⅱ.(1)令平衡时CO的物质的量变化为nmol,利用三段式表示出平衡时CO、CO2的物质的量,化学计量数都是1,利用物质的量代替浓度代入平衡常数计算n的值,进而计算CO的浓度变化量,再利用转化率定义计算CO的转化率;
(2)a.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动;
b.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动;
c.加入合适的催化剂,平衡不移动;
d.移出部分CO2,平衡向正反应移动;
e.粉碎矿石,使其与平衡混合气体充分接触,平衡不移动;
Ⅲ.(3)根据v=$\frac{△c}{△t}$计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);
(4)平衡时混合气体密度是同温同压下起始时的1.6倍,则总物质的量变为原先的$\frac{5}{8}$倍,据此判断反应的方向;
(5)由阴离子移动方向可知B为负极,负极上甲烷失电子发生氧化反应,甲烷被氧化生成二氧化碳和水:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,结合电子守恒计算消耗甲烷的体积.
解答 解:I.已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
②2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)△H=-825.5kJ/mol
则依据盖斯定律计算①×$\frac{3}{2}$-②得到反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-23.5KJ/mol,
故答案为:23.5;
Ⅱ.(1)令平衡时CO的物质的量变化为nmol,则:
$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
开始(mol):1 1
变化(mol):n n
平衡(mol):1-n n+1
所以 $\frac{n+1}{1-n}$=4,解得n=0.6,则CO的平衡转化率为 $\frac{0.6mol}{1mol}$×100%=60%,
故答案为:60%;
(2)a.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故a错误;
b.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故b错误;
c.加入合适的催化剂,平衡不移动,故c错误;
d.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故d正确;
e.粉碎矿石,使其与平衡混合气体充分接触,可以加快反应速率,但平衡不移动,故e错误;
故答案为:d;
Ⅲ.(3)由图可知,达到平衡时甲醇的浓度变化为0.75mol/L,则v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L.min),速率之比等于化学计量数之比,v(H2)=2v(CH3OH)=0.15mol/(L•min),
故答案为:0.15mol/(L•min);
(4)反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积缩小;平衡时混合气体密度是同温同压下起始时的1.6倍,则总物质的量变为原先的$\frac{5}{8}$倍,总物质的量=4×$\frac{5}{8}$=2.5mol,反应前后减少了1.5mol,即化学反应向着正反应方向进行,
故答案为:正;
(5)①燃料电池中燃料在负极发生氧化反应,甲烷失电子在熔融盐中生成二氧化碳气体,B极上的电极反应式为:CH4-8e-+402-=CO2+2H2O,
故答案为:CH4-8e-+402-=CO2+2H2O;
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体位氧气,物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,电极反应为4OH--4e-=2H2O+O2↑,结合单质守恒和电极反应得到 CH4-8e-+402-=CO2+2H2O,CH4~8e-~2O2,则消耗甲烷物质的量0.25mol,标准状况下的体积=0.25mol×22.4L/mol=5.6L,故答案为:5.6;
点评 本题综合考查了化学平衡计算、等效平衡等,Ⅱ中等效平衡的计算,为该题的难点,也是易错点,注意理解等效平衡问题,思维量大,题目难度中等.

 快捷英语周周练系列答案
快捷英语周周练系列答案| 组别 | c(一元酸) | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | c(HX)=0.1mol•L-1 | 0.1 | pH=x |
| 乙 | c(HY)=0.1mol•L-1 | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol•L-1 | 0.1 | pH=9 |
(2)部分实验反应过程中的pH变化曲线如图:

①表示乙组实验的pH变化曲线是图1(填“图1”或“图2”)
②以上两图中表示溶液恰好完全反应的点是BE.
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,所得溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L
②c(OH-)=1.0×10-3 mol•L-1的氨水c L
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.则a、b、c、d的大小关系是b>a=d>c.
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图3中表示醋酸溶液中pH变化曲线的是B(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1 <m2(填“<”、“=”、“>”)
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
| A. | 甲中反应的平衡常数小于乙 | |
| B. | 该温度下,该反应的平衡常数K为400 | |
| C. | SO2的平衡转化率:α1>α2=α3 | |
| D. | 容器中SO3的物质的量浓度:丙=丁<甲 |
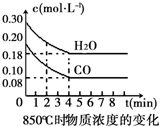 在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O(g)浓度变化如图
在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O(g)浓度变化如图(1)0~4min的平均反应速率v(CO)=0.03mol•L-1•min-1.
(2)该条件下,此反应的平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)c({H}_{2}O)}$(写表达式).
(3)该反应平衡时CO的转化率为60%.
(4)能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
若降低温度,该反应的K值将增大,该反应的化学反应速率将减小(填“增大”“减小”或“不变”).
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0J062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min间,平衡向逆方向移动,可能的原因是D,表中5min~6min之间数值发生变化,可能的原因是A.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
| A. | 1 mol任何物质所含有的原子数都相同 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012 kg C中所含有的碳原子数目为1摩 |
| A. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| B. | Al、Fe、Cu的单质放置在空气中均只生成氧化物 | |
| C. | SiO2与酸、碱均不反应 | |
| D. | 向一定浓度的Na2SiO3溶液中通入适量CO2气体,出现白色沉淀,则H2SiO3的酸性比H2CO3的酸性强 |
 在$\frac{C{u}_{2}O}{ZnO}$做催化剂的条件下,将1molCO(g)和2molH2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH(g)的物质的量(n)与时间(t)及温度的关系如图所示:
在$\frac{C{u}_{2}O}{ZnO}$做催化剂的条件下,将1molCO(g)和2molH2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH(g)的物质的量(n)与时间(t)及温度的关系如图所示:
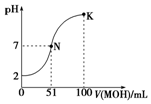 常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题: