题目内容
12.已知: $→_{一定条件}^{CO、HCl}$
$→_{一定条件}^{CO、HCl}$ ,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径: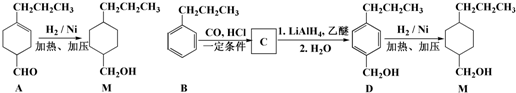
(1)常温下,下列物质能与A发生反应的有bd(填序号).
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)由A催化加氢生成M的过程中,可能有中间生成物
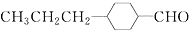 和
和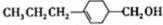 (写结构简式)生成.
(写结构简式)生成.(3)检验D中是否含有C可选用的试剂是银氨溶液(或新制氢氧化铜悬浊液)(任写一种名称).
(4)物质D也可由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为
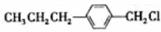 .
.(5)C的一种同分异构体E具有如下特点:
a.分子中含-OCH2CH3 b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式:
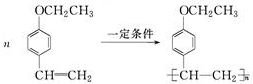 .
.
分析 由合成流程可知,A→M发生-CHO和C=C的加成反应,B→M为苯环的加成反应,结合信息可知,D→C发生取代反应,C为CH3CH2CH2C6H4CHO,名称为对丙基苯甲醛,C→B为-CHO的加成反应,然后结合有机物的结构与性质来解答.
解答 解:由合成流程可知,A→M发生-CHO和C=C的加成反应,B→M为苯环的加成反应,结合信息可知,D→C发生取代反应,C为CH3CH2CH2C6H4CHO,名称为对丙基苯甲醛,C→B为-CHO的加成反应,
(1)含C=C,能与溴水发生加成反应,C=C、-CHO均能被高锰酸钾氧化,
故答案为:bd;
(2)由A催化加氢生成M的过程中,C=C、-CHO均能与氢气发生加成反应,则生成中间体为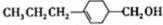 或
或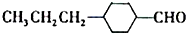 ,
,
故答案为: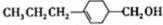 ;
;
(3)D中是否含有C,利用醛基的性质可知,选银氨溶液(或新制氢氧化铜悬浊液)产生银镜(或砖红色沉淀)即可证明,
故答案为:银氨溶液(或新制氢氧化铜悬浊液);
(4)B也可由C10H13Cl与NaOH水溶液共热生成,碳链骨架不变,则C10H13Cl的结构简式为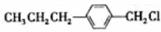 ,
,
故答案为: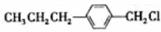 ;
;
(5)C为CH3CH2CH2C6H4CHO,其同分异构体E具有如下特点:
a.分子中含-OCH2CH3、b.苯环上只有两种化学环境不同的氢原子,则另一取代基为乙烯基,二者为对位的位置,苯环上只有两种H,
则E在一定条件下发生加聚反应的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的合成,题目难度中等,注意信息分析C物质,体会官能团与性质的关系,把握反应条件、反应类型及官能团变化即可解答,有机合成题是高考热点题型.

练习册系列答案
相关题目
2.分类是化学研究的重要方法之一,下列有关说法中,正确的是( )
| A. | SO2、NO2和CO2都属于酸性氧化物 | |
| B. | 甲烷和和一氯甲烷都属于烷烃 | |
| C. | 碱性氧化物都是金属氧化物 | |
| D. | 在水溶液中能电离出H+的化合物都属于酸 |
3.纯二氧化硅可用来制造光纤.某稻壳灰的成分为:
通过如下流程可由稻壳灰制备较纯净的二氧化硅.

请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中涉及的氧化物最多有3类.
(2)步骤①中涉及与NaOH反应的离子反应方程式为SiO2+2OH-═SiO32-+H2O、Al2O3+2OH-═2AlO2-+H2O.
(3)滤渣A的成分有C和Fe2O3(填化学式)
(4)步骤②洗涤时,检验是否洗涤干净的方法是:取最后一次洗涤液少量,加入硝酸银溶液,若不出现沉淀,即洗涤干净.
(5)实验室进行步骤③用到的仪器有坩埚钳、酒精灯、三脚架、坩埚和泥三角.
| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |

请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中涉及的氧化物最多有3类.
(2)步骤①中涉及与NaOH反应的离子反应方程式为SiO2+2OH-═SiO32-+H2O、Al2O3+2OH-═2AlO2-+H2O.
(3)滤渣A的成分有C和Fe2O3(填化学式)
(4)步骤②洗涤时,检验是否洗涤干净的方法是:取最后一次洗涤液少量,加入硝酸银溶液,若不出现沉淀,即洗涤干净.
(5)实验室进行步骤③用到的仪器有坩埚钳、酒精灯、三脚架、坩埚和泥三角.
7.下列物质中,属于芳香烃且属于苯的同系物的是( )
| A. |  | B. |  | C. |  | D. |  |
17.下列实验方法或操作能达到实验目的是( )
| A. | 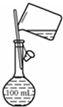 配制150mL 0.1 mol/L盐酸 | B. |  验证氨水呈碱性 | ||
| C. | 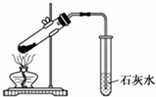 探究NaHCO3的热稳定性 | D. | 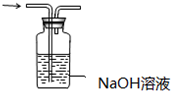 除去二氧化碳中的氯化氢 |
4.下列解释实验事实的方程式正确的是( )
| A. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| B. | 铜片溶于稀硝酸产生无色气体:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 氢氧化亚铁在空气中变质:2Fe(OH)2+O2+2H2O═2Fe(OH)3 | |
| D. | 碳酸钠溶液呈碱性:CO32-+2H2O?H2CO3+2OH- |
1.当光线通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 稀盐酸 | B. | CuSO4溶液 | C. | 酒精溶液 | D. | Fe(OH)3胶体 |
2. 汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
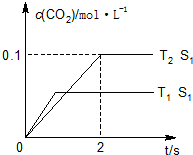
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H<0(填“>”“<”).
②在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s).
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
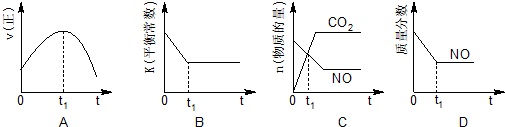
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)和H2O(g)的热化学方程式CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)已知反应:CO2(g)+H2(g)?CO(g)+H2O(g),现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中进行反应,得到如下两组数据:
①实验1条件下平衡常数K=4.57(保留小数点后二位).
②该反应的△H>0(填“<”或“>”).
 汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H<0(填“>”“<”).
②在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s).
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)和H2O(g)的热化学方程式CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)已知反应:CO2(g)+H2(g)?CO(g)+H2O(g),现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中进行反应,得到如下两组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO2(g) | H2(g) | H2O(g) | CO2(g) | |||
| 1 | 650 | 2 | 1 | 0.4 | 1.6 | 6 |
| 2 | 900 | 4 | 2 | 1.6 | 2.4 | 2 |
②该反应的△H>0(填“<”或“>”).