题目内容
某校化学兴趣小组同学,利用如图所示装置探究pH试纸上的微型电解.
(1)如图1所示,取一条广泛pH试纸,浸润了饱和Na2SO4溶液后放置于玻璃片上,取两只回形针(铁制)夹住试纸两端,另取导线、鳄鱼夹、6v电池连接好电路.当两根鳄鱼夹夹住回形针后,试纸上立刻出现以下现象:阳极回形针处很快出现大片红棕色阴极附近迅速呈现大片蓝紫色,对照比色卡发现其pH约为13.
①如图,右端回形针为 极(填“阴”或“阳”);阴极试纸上出现大片蓝紫色的原因是(用电极反应式表示): .
②推测阳极回形针处出现的红棕色物质可能是 (写化学式),为证明该种物质的存在,请设计一个简单的实验,该实验的操作过程是: .
(2)小组同学另取两根铅笔芯作为电极,对pH试纸上的Na2SO4溶液电解,可见阳极与试纸接触处呈现 色圆点,而在阴极与试纸接触处呈现 色圆点,说明了电解硫酸钠饱和溶液的实质是: (用方程式表示).
(3)将pH试纸用饱和NaCl浸润,采用类似(2)操作,如图2所示.接通直流电源一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.请分析此极出现该现象的原因:(用必要文字及方程式表述) .

(1)如图1所示,取一条广泛pH试纸,浸润了饱和Na2SO4溶液后放置于玻璃片上,取两只回形针(铁制)夹住试纸两端,另取导线、鳄鱼夹、6v电池连接好电路.当两根鳄鱼夹夹住回形针后,试纸上立刻出现以下现象:阳极回形针处很快出现大片红棕色阴极附近迅速呈现大片蓝紫色,对照比色卡发现其pH约为13.
①如图,右端回形针为
②推测阳极回形针处出现的红棕色物质可能是
(2)小组同学另取两根铅笔芯作为电极,对pH试纸上的Na2SO4溶液电解,可见阳极与试纸接触处呈现
(3)将pH试纸用饱和NaCl浸润,采用类似(2)操作,如图2所示.接通直流电源一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.请分析此极出现该现象的原因:(用必要文字及方程式表述)
考点:电解原理
专题:电化学专题
分析:(1)①依据装置图分析与电源正极相连的电极为阳极,与电源负极相连的电极为阴极;浸润了饱和Na2SO4溶液通电电解阴极是氢离子得到电子发生还原反应;
②铁制回形针做电解池的阳极失去电子生成的亚铁离子结合氢氧根离子是氢氧化亚铁,被氧化为氢氧化铁,分解生成红色氧化铁;依据铁离子的检验方法进行试验设计检验存在铁离子;
(2)惰性电极对Na2SO4溶液电解,实质是电解水,阳极氢氧根离子失电子发生氧化反应生成氧气,附近水电离破坏生成氢离子浓度增大;阴极是氢离子得到电子发生还原反应生成氢气,附近水电离破坏生成氢氧根离子浓度增大;
(3)惰性电极电解饱和氯化钠溶液阳极是氯离子失电子生成氯气,氯气和水反应生成盐酸和次氯酸;盐酸显酸性,次氯酸具有漂白性.
②铁制回形针做电解池的阳极失去电子生成的亚铁离子结合氢氧根离子是氢氧化亚铁,被氧化为氢氧化铁,分解生成红色氧化铁;依据铁离子的检验方法进行试验设计检验存在铁离子;
(2)惰性电极对Na2SO4溶液电解,实质是电解水,阳极氢氧根离子失电子发生氧化反应生成氧气,附近水电离破坏生成氢离子浓度增大;阴极是氢离子得到电子发生还原反应生成氢气,附近水电离破坏生成氢氧根离子浓度增大;
(3)惰性电极电解饱和氯化钠溶液阳极是氯离子失电子生成氯气,氯气和水反应生成盐酸和次氯酸;盐酸显酸性,次氯酸具有漂白性.
解答:
解:(1)①与电源正极相连的电极为阳极,与电源负极相连的电极为阴极;浸润了饱和Na2SO4溶液通电电解阴极是氢离子得到电子发生还原反应,回形针与电源正极相连做电解池的阳极,溶液中的氢离子在阴极得到电子发生还原反应,电极反应为:2H2O+2e-→H2↑+2OH-,
故答案为:阳;2H2O+2e-→H2↑+2OH-;
②铁制回形针做电解池的阳极失去电子生成的亚铁离子结合氢氧根离子是氢氧化亚铁,被氧化为氢氧化铁,分解生成红色氧化铁;依据铁离子的检验方法进行试验设计检验存在铁离子,从试纸上刮下少许红棕色物质置于试管中,加稀盐酸至完全溶解后,(发现溶液呈棕黄色,)滴加一滴KSCN溶液振荡,溶液出现血红色,从而证明推测;
故答案为:氧化铁;从试纸上刮下少许红棕色物质置于试管中,加稀盐酸至完全溶解后,(发现溶液呈棕黄色,)滴加一滴KSCN溶液振荡,溶液出现血红色,从而证明推测;
(2)惰性电极对Na2SO4溶液电解,实质是电解水,反应的化学方程式为:2H2O
2H2↑+O2↑;阳极氢氧根离子失电子发生氧化反应生成氧气,附近水电离破坏生成氢离子浓度增大,试纸变红色;阴极是氢离子得到电子发生还原反应生成氢气,附近水电离破坏生成氢氧根离子浓度增大,试纸变蓝色;
故答案为:红;蓝; 2H2O
2H2↑+O2↑;
(3)将pH试纸用饱和NaCl浸润,惰性电极电解饱和氯化钠溶液阳极是氯离子失电子生成氯气,氯气和水反应生成盐酸和次氯酸;盐酸显酸性外圈变红,次氯酸具有漂白性内圈变白色;
故答案为:a极为阳极,电极反应式为:2Cl-→Cl2↑+2e-,氯气溶于水发生反应:Cl2+H2O═HClO+HCl,HClO具有漂白性使pH试纸变白色(内圈),氯水呈酸性因而外圈出现浅红色.
故答案为:阳;2H2O+2e-→H2↑+2OH-;
②铁制回形针做电解池的阳极失去电子生成的亚铁离子结合氢氧根离子是氢氧化亚铁,被氧化为氢氧化铁,分解生成红色氧化铁;依据铁离子的检验方法进行试验设计检验存在铁离子,从试纸上刮下少许红棕色物质置于试管中,加稀盐酸至完全溶解后,(发现溶液呈棕黄色,)滴加一滴KSCN溶液振荡,溶液出现血红色,从而证明推测;
故答案为:氧化铁;从试纸上刮下少许红棕色物质置于试管中,加稀盐酸至完全溶解后,(发现溶液呈棕黄色,)滴加一滴KSCN溶液振荡,溶液出现血红色,从而证明推测;
(2)惰性电极对Na2SO4溶液电解,实质是电解水,反应的化学方程式为:2H2O
| ||
故答案为:红;蓝; 2H2O
| ||
(3)将pH试纸用饱和NaCl浸润,惰性电极电解饱和氯化钠溶液阳极是氯离子失电子生成氯气,氯气和水反应生成盐酸和次氯酸;盐酸显酸性外圈变红,次氯酸具有漂白性内圈变白色;
故答案为:a极为阳极,电极反应式为:2Cl-→Cl2↑+2e-,氯气溶于水发生反应:Cl2+H2O═HClO+HCl,HClO具有漂白性使pH试纸变白色(内圈),氯水呈酸性因而外圈出现浅红色.
点评:本题考查了电解原理的分析判断和电解过程中的电极名称,电解产物,电极反应的书写,溶液酸碱性的判断,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各组互为同位素的是( )
A、
| ||||
| B、H2和D2 | ||||
| C、H2O和D2O | ||||
| D、O2和O3 |
能用离子方程式H++OH═H2O表示的反应是( )
| A、稀醋酸和稀氨水反应 |
| B、稀硫酸和烧碱溶液反应 |
| C、稀盐酸和氢氧化铜反应 |
| D、稀硫酸和氢氧化钡溶液反应 |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,22.4 L CO2和O2混合气体中含有的氧原子数约为NA |
| B、300 mL 2 mol?L-1蔗糖溶液中所含分子数为0.6 NA |
| C、1 L 1 mol?L-1的K2CO3溶液中离子总数大于3NA |
| D、常温常压下,2.24 L四氯化碳中所含氯原子数约小于0.4 NA |

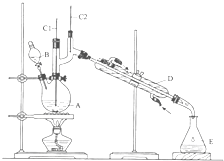 正丁醛是一种化工原料.某实验小组利用如图所示装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如图所示装置合成正丁醛. 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.