题目内容
把氯气通入浓氨水中,会立即发生下列反应:3Cl2+8NH3?H2O═6NH4Cl+N2+8H2O.在标准状况下,把1.12L Cl2、N2的混合气体(90%Cl2和10%N2,均为体积分数)通过浓氨水,实验测得逸出气体体积为0.672L(其中有50%Cl2和50%N2),此反应中被氧化的NH3的质量为( )
| A、3.4 g |
| B、0.34 g |
| C、1.36 g |
| D、4.48 g |
考点:氧化还原反应的计算,氨的化学性质
专题:氮族元素
分析:1.12L Cl2、N2的混合气体中n(Cl2)=
=0.045mol,
逸出气体体积为0.672L(其中有50%Cl2和50%N2),n(Cl2)=
=0.015mol,
则反应的氯气n(Cl2)=0.045mol-0.015mol=0.03mol,
结合反应的化学方程式计算.
| 1.12L×90% |
| 22.4L/mol |
逸出气体体积为0.672L(其中有50%Cl2和50%N2),n(Cl2)=
| 0.672L×50% |
| 22.4L/mol |
则反应的氯气n(Cl2)=0.045mol-0.015mol=0.03mol,
结合反应的化学方程式计算.
解答:
解:已知3Cl2+8NH3?H2O═6NH4Cl+N2+8H2O,由方程式可知3mol氯气和氧化2mol氨气,
1.12L Cl2、N2的混合气体中n(Cl2)=
=0.045mol,
逸出气体体积为0.672L(其中有50%Cl2和50%N2),n(Cl2)=
=0.015mol,
则反应的氯气n(Cl2)=0.045mol-0.015mol=0.03mol,
则由方程式可知氧化的NH3的物质的量为0.02mol,
质量为0.02mol×17g/mol=0.34g,
故选B.
1.12L Cl2、N2的混合气体中n(Cl2)=
| 1.12L×90% |
| 22.4L/mol |
逸出气体体积为0.672L(其中有50%Cl2和50%N2),n(Cl2)=
| 0.672L×50% |
| 22.4L/mol |
则反应的氯气n(Cl2)=0.045mol-0.015mol=0.03mol,
则由方程式可知氧化的NH3的物质的量为0.02mol,
质量为0.02mol×17g/mol=0.34g,
故选B.
点评:本题考查氧化还原反应的计算,题目难度不大,注意根据氯气体积的变化结合反应的化学方程式计算该题,答题时注意氨气被氧化与参加反应的总量的关系.

练习册系列答案
相关题目
下列溶液中溶质的物质的量浓度为1mol?L-1的是( )
| A、将40g NaOH溶解于1L水中配成的NaOH溶液 |
| B、常温常压下将22.4L HCl 气体溶于水配成1L的盐酸溶液 |
| C、将100mL 10 mol?L-1的浓盐酸加水900mL混合所配成的溶液 |
| D、从1000mL 1 mol?L-1 NaCl溶液中取出100mL的溶液 |
下列各组离子能在溶液中大量共存的是( )
| A、H+、Ba2+、NO3-、OH- |
| B、Mg2+、Na+、Cl-、OH- |
| C、Na+、H+、NO3-、CO32- |
| D、Cu2+、Fe3+、Cl-、SO42- |
下列各组互为同位素的是( )
A、
| ||||
| B、H2和D2 | ||||
| C、H2O和D2O | ||||
| D、O2和O3 |


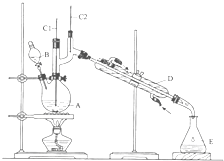 正丁醛是一种化工原料.某实验小组利用如图所示装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如图所示装置合成正丁醛.