题目内容
5. 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.已知:高锰酸钾在常温下与浓盐酸反应产生氯气.
(1)如果C中装饱和的H2S溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,证明氯的非金属性比硫的非金属性强(填“强”或“弱”或“无法判断”).
(2)利用如图装置证明Cl2氧化性强于I2的氧化性.则A中装浓盐酸,B中装入高锰酸钾
粉末,C中装入淀粉KI溶液,则C中现象是淀粉-KI溶液变蓝色
(3)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:非金属性:N>C>Si.C中装试剂硅酸钠溶液,实验现象为有白色沉淀生成该装置存在不足之处,改进措施为:在B、C之间加一个盛饱和NaHCO3溶液的洗气瓶.
分析 (1)中装浓盐酸,B中装高锰酸钾溶液反应生成氯气具有氧化性,通入饱和氢硫酸溶液,反应开始后观察现象是C中产生淡黄色沉淀,说明氯气氧化硫化氢为硫单质;单质氧化剂的氧化性大于氧化产物,判断非金属性;
(2)氯气将碘离子氧化为碘单质,碘单质遇到淀粉变蓝色;
(3)有机强酸能制弱酸的规律结合硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3可以得到:非金属性:N>C>Si.
解答 解:(1)果C中装饱和氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察现象是C中产生淡黄色沉淀,反应的化学方程式为:Cl2+H2S═S↓+2HCl;证明氯元素比硫元素非金属性强,故答案为:强;
(2)盐酸和高锰酸钾之间反应产生氯气,氯气将碘离子氧化为碘单质,碘单质遇到淀粉变蓝色,故答案为:淀粉-KI溶液变蓝色;
(3)现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3;因此先加入硝酸和碳酸钙反应生成二氧化碳,二氧化碳通入硅酸钠溶液生成硅酸沉淀;装置C中反应是:CO2+SiO32-+H2O=H2SiO3↓+CO32-,C中装试剂硅酸钠溶液;现象为有白色沉淀生成;但是浓硝酸具有挥发性,防止硝酸和硅酸钠之间反应的干扰,所以在B、C之间加一个盛饱和NaHCO3溶液的洗气瓶,
故答案为:硅酸钠溶液;有白色沉淀生成;在B、C之间加一个盛饱和NaHCO3溶液的洗气瓶.
点评 本题考查了酸性强弱的比较实验设计,试剂选择,离子方程式的书写,熟练掌握物质性质是解题关键.题目难度中等.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
15.下列化学用语表述正确的是( )
| A. | HC1的电子式: | B. | NaCl的电子式: | ||
| C. | S2-的原子结构示意图: | D. | H2O2的电子式: |
13.在实验室中,下列除去杂质的方法正确的是( )
| A. | 硝基苯中混有的少量硫酸和硝酸,将其倒入盛有NaOH溶液的分液漏斗中,振荡,静置,分液 | |
| B. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出碘 | |
| D. | 乙烯中混有SO2和CO2,将其通入溴水中洗气 |
20.不能使化学反应:CO(g)+NO2(g)=CO(g)+N2(g)速率增大的措施是( )
| A. | 增加CO的量 | B. | 增大压强 | C. | 升高温度 | D. | 加入稀有气体 |
10.下列物质与其用途不完全符合的有( )
①干冰-人工降雨;
②Na2CO3-制玻璃;
③Fe2O3-红色油漆或涂料;
④Al2O3-耐火材料;
⑤NaClO-净水剂
⑥NaHCO3-制食品发泡剂;
⑦KAl(SO4)2-消毒、净水.
①干冰-人工降雨;
②Na2CO3-制玻璃;
③Fe2O3-红色油漆或涂料;
④Al2O3-耐火材料;
⑤NaClO-净水剂
⑥NaHCO3-制食品发泡剂;
⑦KAl(SO4)2-消毒、净水.
| A. | ⑤⑦ | B. | ②④⑥⑧ | C. | ③④ | D. | ①③⑤⑦ |
14.下列有关物质的性质或应用的说法不正确的是( )
| A. | 石油裂解可获得乙烯、丙烯和丁二烯 | |
| B. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 天然植物油常温下一般呈液态,难溶于水,有固定的熔点、沸点 | |
| D. | 酚醛树脂、聚酯纤维(涤纶)都是由缩聚反应制得的高分子化合物 |
15.80℃时,2L 密闭容器中充入0.40mol N2O4,发生反应N2O4?2NO2 △H=+53kJ/mol,获得如表数据,下列判断正确的是( )
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol•L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A. | 升高温度该反应的平衡常数K减小 | |
| B. | 该反应的△S<0 | |
| C. | 反应达平衡时吸热15.9kJ | |
| D. | 100s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率减小 |
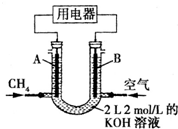 将CH4设计成燃料电池,其利用率更高,装置如右图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
将CH4设计成燃料电池,其利用率更高,装置如右图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L. 高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.
高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.