题目内容
14.下列有关物质的性质或应用的说法不正确的是( )| A. | 石油裂解可获得乙烯、丙烯和丁二烯 | |
| B. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 天然植物油常温下一般呈液态,难溶于水,有固定的熔点、沸点 | |
| D. | 酚醛树脂、聚酯纤维(涤纶)都是由缩聚反应制得的高分子化合物 |
分析 A.裂解的目的是为了获得乙烯、丙烯、丁二烯、丁烯等;
B.煤干馏可以得到煤焦油,煤焦油中含有甲烷、苯和氨等重要化工原料;
C.混合物没有固定熔沸点;
D.缩聚反应是一类有机化学反应,是具有两个或两个以上官能团的单体,相互反应生成高分子化合物,同时产生有简单分子(如 H2O、HX、醇等)的化学反应;
解答 解:A.石油的裂解可获得乙烯、丙烯、丁二烯、丁烯等短链烯烃,故A正确;
B.因煤干馏可以得到煤焦油,煤焦油中含有甲烷、苯和氨等重要化工原料,可以通过分馏的方法进行分离,所以煤干馏可以得到甲烷、苯和氨等重要化工原料,故B正确;
C.天然植物油为混合物,不具有固定熔沸点,故C错误;
D.酚醛树脂是由苯酚和甲醛在催化剂条件下缩聚、经中和、水洗而制成的树脂,聚酯纤维是由饱和的二元酸与二元醇通过缩聚反应制得的一类线性高分子缩聚物,故D正确;
故选:C.
点评 本题考查石油的炼制、煤的干馏及有机物的结构与性质,明确石油裂解、煤干馏产物是解题关键,注意混合物不具有固定熔沸点,题目难度不大.

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
4.下列化学实验事实及其结论都正确的是( )
| A. | 将SO2通入含HClO的溶液中生成H2SO4 HClO的酸性比H2SO4强 | |
| B. | 铝箔在酒精灯火焰上加热熔化但不滴落 铝箔表面氧化铝熔点高于铝 | |
| C. | SiO2可以和碱溶液及酸溶液反应 SiO2属于两性氧化物 | |
| D. | 将SO2通入溴水中,溴水褪色 SO2具有漂白性 |
19.含氮化合物是化学与工业中运用广泛的物质.
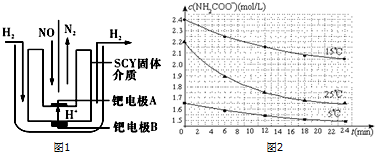
(1)该小组利用电解原理设计了如图1装置进行H2还原NO的实验(高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极).铂电极B是阳极,钯电极A的电极反应式为2NO+4H++4e-=N2+2H2O.
(2)若工业废水中的NO2-的浓度约为1.0×10-4 mol•L-1,取工业废水5mL 于试管中,滴加2滴0.1mol•L-1的硝酸银溶液,能否看到沉淀现象?试通过计算说明.(注:1mL溶液以20滴计;Ksp(AgNO2)=2×10-8)
(3)已知键能数据,H-H 436,S=S 255,H-S 339,单位kJ/mol.请计算热化学方程式2H2(g)+S2(g)=2H2S(g)的△H=-229KJ/mol
(4)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于下表:
?根据表中数据,列式计算25.0℃时的分解平衡常数:K=c(CO2)•c2(NH3)=[4.8×10-3×$\frac{2}{3}$]2×[4.8×10-3×$\frac{1}{3}$]=1.64×10-8.
?已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.根据图中信息,如何说明水解反应速率随温度升
高而增大:25.00C时反应物的起始浓度较小,但0-6min的平均反应速率(曲线的斜率)仍比15.00C的大.

(1)该小组利用电解原理设计了如图1装置进行H2还原NO的实验(高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极).铂电极B是阳极,钯电极A的电极反应式为2NO+4H++4e-=N2+2H2O.
(2)若工业废水中的NO2-的浓度约为1.0×10-4 mol•L-1,取工业废水5mL 于试管中,滴加2滴0.1mol•L-1的硝酸银溶液,能否看到沉淀现象?试通过计算说明.(注:1mL溶液以20滴计;Ksp(AgNO2)=2×10-8)
(3)已知键能数据,H-H 436,S=S 255,H-S 339,单位kJ/mol.请计算热化学方程式2H2(g)+S2(g)=2H2S(g)的△H=-229KJ/mol
(4)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
?已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.根据图中信息,如何说明水解反应速率随温度升
高而增大:25.00C时反应物的起始浓度较小,但0-6min的平均反应速率(曲线的斜率)仍比15.00C的大.
6.下列选项中符合如图关系的是( )
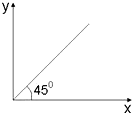

| A. | 第二周期的核电荷数和最高化合价之间的关系 | |
| B. | 烷烃中碳原子数(X)与氢原子数(Y)的关系 | |
| C. | 温度大于100℃时,CH4和C2H4的混合气体在氧气中充分燃烧,同温同压下燃烧前后参与反应的气体的体积之和(X)与生成物的气体体积之和(Y)的关系 | |
| D. | 燃烧一定质量C2H4与C3H6的混合气体,消耗O2的物质的量(Y)与C3H6的质量分数(X)的关系 |
3.分子式为C9H11Cl芳香族化合物,其苯环上的一溴代物有两种,满足此条件的同分异构体有( )种.
| A. | 10 | B. | 11 | C. | 13 | D. | 14 |
6.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
(1)该反应的离子方程式为(提示:H2C2O4的一级电离常数为5.4×10-2)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O; 每消耗1mol H2C2O4转移2mol 电子.
(2)实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol•L-1)的用量均为2mL.如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4个实验进行对比即可得出结论.
(3)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
①计算用0.001mol•L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率1×10-4mol•L-1•min-1.
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?若可行,说明理由;若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:否(或:不可行),取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.
(1)该反应的离子方程式为(提示:H2C2O4的一级电离常数为5.4×10-2)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O; 每消耗1mol H2C2O4转移2mol 电子.
(2)实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol•L-1)的用量均为2mL.如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4个实验进行对比即可得出结论.
(3)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
| KMnO4酸性溶液 的浓度/mol•L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 12 |
| 0.001 | 6 | 7 | 7 |
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?若可行,说明理由;若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:否(或:不可行),取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.
 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.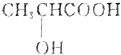 )有一对手性异构体,因为其分子中含有一个手性碳原子.
)有一对手性异构体,因为其分子中含有一个手性碳原子.