题目内容
15.下列化学用语表述正确的是( )| A. | HC1的电子式: | B. | NaCl的电子式: | ||
| C. | S2-的原子结构示意图: | D. | H2O2的电子式: |
分析 A、氯化氢属于共价化合物,分子中不存在阴阳离子;
B、氯化钠是离子化合物,根据离子化合物的电子式书写方法来写;
C、硫离子的核外有18个电子;
D、双氧水为共价化合物.
解答 解:A、氯化氢为共价化合物,电子式中不能标出电荷,氯化氢正确的电子式为 ,故A错误;
,故A错误;
B、氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为 ,故B错误;
,故B错误;
C、硫离子的核内有16个质子,核外有18个电子,故结构示意图为 ,故C正确;
,故C正确;
D、双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为 ,故D错误.
,故D错误.
故选C.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
5.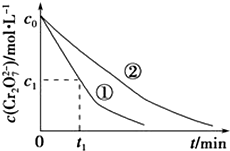 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格).
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示.
(2)上述反应后草酸被氧化的离子方程式为Cr2O72-+3H2C2O4+8H+=6CO2↑+2Cr3++7H2O
(3)实验①和②的结果表明溶液PH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;
…
(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格).
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
(2)上述反应后草酸被氧化的离子方程式为Cr2O72-+3H2C2O4+8H+=6CO2↑+2Cr3++7H2O
(3)实验①和②的结果表明溶液PH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;
…
(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后,若溶液中c(Cr2O72-)大于实验①中c(Cr2O72-),则假设一成立;若两溶液中的c(Cr2O72-)相同,则假设一不成立 |
6.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 氧化钙溶于水 | B. | 铁粉溶于稀硫酸 | ||
| C. | 盐酸与氢氧化钠反应 | D. | 氢氧化钡晶体与氯化铵晶体混合 |
3.A元素原子最外层电子数是次外层电子数的3倍,B元素原子最外层电子数是次外层电子数的一半,则A、B元素( )
| A. | 一定是第二周期元素 | B. | 一定是同一主族元素 | ||
| C. | 可能是第二、三周期元素 | D. | A、B只能形成化合物B2A |
10.既能跟盐酸又能跟氢氧化钠溶液反应的物质是( )
| A. | MgO | B. | Al(OH)3 | C. | HNO3 | D. | CaCO3 |
20.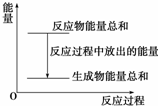 对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
 对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )| A. | Zn和H2SO4的总能量大于ZnSO4和H2的总能量 | |
| B. | 反应过程中能量关系可用如图表示 | |
| C. | 若将该反应设计成原电池,则Zn为负极 | |
| D. | 若将该反应设计成原电池,当有32.5g锌溶解时,正极放出11.2 L气体 |
7.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 反应物总能量低于生成物总能量时,该反应一定不能发生 | |
| B. | 化学键的键能越大,物质的能量越高 | |
| C. | 一个反应的焓变因反应物的用量和反应条件的改变而发生改变 | |
| D. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |
4.下列化学实验事实及其结论都正确的是( )
| A. | 将SO2通入含HClO的溶液中生成H2SO4 HClO的酸性比H2SO4强 | |
| B. | 铝箔在酒精灯火焰上加热熔化但不滴落 铝箔表面氧化铝熔点高于铝 | |
| C. | SiO2可以和碱溶液及酸溶液反应 SiO2属于两性氧化物 | |
| D. | 将SO2通入溴水中,溴水褪色 SO2具有漂白性 |
 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.