题目内容
10.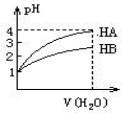 常温时,pH=1的两种一元酸HA和HB溶液,分别加水稀释1000倍,两溶液的pH与所加水的体积变化如图所示,下列结论中正确的是( )
常温时,pH=1的两种一元酸HA和HB溶液,分别加水稀释1000倍,两溶液的pH与所加水的体积变化如图所示,下列结论中正确的是( )| A. | 在稀释过程中当两者pH分别都是2时,c(HA)>c(HB) | |
| B. | 当稀释100倍时,HB溶液的pH=2 | |
| C. | 在稀释过程中HA与HB溶液中c(OH-)均增大 | |
| D. | 等体积pH=1的HA和HB溶液分别用等物质的量浓度的NaOH溶液中和,消耗碱溶液体积HA等于HB |
分析 由图可知,HA开始的pH=1,稀释1000倍pH=4,则HA为强酸,而HB开始的pH=1,稀释1000倍pH大于2小于3,则HB为弱酸,并根据酸碱中和及电离来解答.
A.图象分析PH变化可知HA为强酸,HB为弱酸,在稀释过程中当两者pH分别都是2时,弱酸浓度大;
B.分析可知HB为弱酸,稀释100倍,氢离子浓度减小少于100倍,弱酸电离被促进;
C.常温下,PH=1的酸溶液稀释1000倍,图象分析PH变化可知HA为强酸,HB为弱酸,稀释过程中氢离子浓度减小,离子积常数分析,氢氧根离子浓度增大;
D.等体积pH=1的HA和HB溶液,HA为强酸,HB为弱酸,弱酸中酸的浓度大于氢离子的浓度,所以HB的浓度大于HA的浓度.
解答 解:A.图象分析PH变化可知HA为强酸,HB为弱酸,在稀释过程中当两者pH分别都是2时,弱酸浓度大,c(HA)<c(HB),故A错误;
B.分析可知HB为弱酸,稀释100倍,弱酸电离被促进,HB的pH小于3,稀释1000倍pH大于2小于3,故B错误;
C.常温下,PH=1的酸溶液稀释1000倍,图象分析PH变化可知HA为强酸,HB为弱酸,稀释过程中氢离子浓度减小,离子积常数Kw=c(OH-)•c(H+)分析,氢氧根离子浓度增大,故C正确;
D.HA为强酸,HB为弱酸,pH=1的HA和HB溶液,弱酸中酸的浓度大于氢离子的浓度,HB的浓度大于HA的浓度,向等体积pH=1的HA和HB溶液中滴加等浓度的NaOH溶液,最终HB消耗碱溶液体积比HA需要的NaOH多,故D错误;
故选C.
点评 本题考查了酸碱反应后溶液酸碱性分析判断,溶液中离子积常数分析应用,注意弱电解质存在电离平衡的特征是解答关键,题目难度中等.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
20.关于下列各装置图的叙述不正确的是( )
| A. | 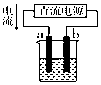 用装置精炼铜,则b极为精铜,电解质溶液为CuSO4溶液 | |
| B. | 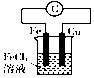 装置的总反应是Cu+2Fe3+=Cu2++2Fe2+ | |
| C. | 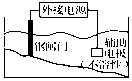 装置中钢闸门应与外接电源的负极相连 | |
| D. | 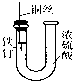 装置中的铁钉浸入浓硫酸中几乎没被腐蚀 |
18.下列物质或溶液不能与CO2和 SO2反应的是( )
| A. | Na2O2 | B. | CaCl2溶液 | C. | Na2SiO3溶液 | D. | Na2CO3溶液 |
5.化学与环境密切相关,下列说法错误的是( )
| A. | 酸雨是指pH<5.6的雨水 | |
| B. | 二氧化碳大量排放会造成温室效应 | |
| C. | 白色污染会造成“水华”和“赤潮” | |
| D. | 燃煤中掺入生石灰能有效减少SO2的排放 |
14.下列说法不正确的是( )
| A. | 裂化汽油可以用于萃取溴水中的溴 | |
| B. | 甘氨酸和丙氨酸缩合最多可形成4种二肽 | |
| C. | 盛放过苯酚的试剂瓶中残留的苯酚用酒精洗涤 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |

 、NaOH
、NaOH .
.