题目内容
5.化学与环境密切相关,下列说法错误的是( )| A. | 酸雨是指pH<5.6的雨水 | |
| B. | 二氧化碳大量排放会造成温室效应 | |
| C. | 白色污染会造成“水华”和“赤潮” | |
| D. | 燃煤中掺入生石灰能有效减少SO2的排放 |
分析 A.雨水溶解二氧化硫使酸性增强;
B.温室效应与二氧化碳有关;
C.白色污染与塑料有关;
D.CaO与二氧化硫反应,可减少二氧化硫的排放.
解答 解:A.雨水溶解二氧化硫使酸性增强,则雨水的pH<5.6,为酸雨,故A正确;
B.温室效应与二氧化碳有关,则二氧化碳大量排放会造成温室效应,故B正确;
C.白色污染与塑料有关,而“水华”和“赤潮”与N、P的化合物排放引起水污染有关,故C错误;
D.CaO与二氧化硫反应,可减少二氧化硫的排放,可减少酸雨的发生,故D正确;
故选C.
点评 本题考查三废处理及环境保护,为高频考点,把握环境污染物、环保问题为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
15.下列反应既是离子反应,又是氧化还原反应的是( )
| A. | 氢气还原氧化铜 | |
| B. | 二氧化碳与氢氧化钠溶液作用生成碳酸氢钠 | |
| C. | 硫化氢通入氯化铁溶液中生成硫、氯化亚铁和盐酸 | |
| D. | 氯酸钾分解制氧气 |
16. X、Y、Z、W、Q是原子序教依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位里关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序教依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位里关系如图.下列说法正确的是( )
 X、Y、Z、W、Q是原子序教依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位里关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序教依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位里关系如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y的氢化物的沸点比W的氢化物的沸点低 | |
| C. | Y与Z 形成的化合物都可以和盐酸反应 | |
| D. | Z与Q形成的化合物的水解液一定显酸性 |
13.短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20.则下列说法不正确的是( )
| X | Y | |||
| W | Z |
| A. | 最高价氧化物的水化物的酸性:X<Z | |
| B. | 电负性大小:Y<Z | |
| C. | 离子半径大小:W<Y | |
| D. | W的最高价氧化物的水化物具有两性 |
10.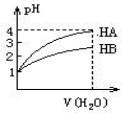 常温时,pH=1的两种一元酸HA和HB溶液,分别加水稀释1000倍,两溶液的pH与所加水的体积变化如图所示,下列结论中正确的是( )
常温时,pH=1的两种一元酸HA和HB溶液,分别加水稀释1000倍,两溶液的pH与所加水的体积变化如图所示,下列结论中正确的是( )
 常温时,pH=1的两种一元酸HA和HB溶液,分别加水稀释1000倍,两溶液的pH与所加水的体积变化如图所示,下列结论中正确的是( )
常温时,pH=1的两种一元酸HA和HB溶液,分别加水稀释1000倍,两溶液的pH与所加水的体积变化如图所示,下列结论中正确的是( )| A. | 在稀释过程中当两者pH分别都是2时,c(HA)>c(HB) | |
| B. | 当稀释100倍时,HB溶液的pH=2 | |
| C. | 在稀释过程中HA与HB溶液中c(OH-)均增大 | |
| D. | 等体积pH=1的HA和HB溶液分别用等物质的量浓度的NaOH溶液中和,消耗碱溶液体积HA等于HB |
9.把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡;另一份加入含b mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁.则原混合溶液中钾离子的浓度为( )
| A. | $\frac{a-b}{V}$ mol•L-1 | B. | $\frac{2a-b}{V}$ mol•L-1 | C. | $\frac{2(a-b)}{V}$ mol•L-1 | D. | $\frac{2(2a-b)}{V}$ mol•L-1 |