题目内容
下列各组性质对比正确的是( )
| A、原子半径:O>N>C |
| B、酸性:HClO4>H2SO4>H3PO4 |
| C、稳定性:HCl>HI>HBr |
| D、金属性:Al>Mg>Na |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A、同一周期元素原子半径从左到右逐渐减小,因此原子半径:C>N>O;
B、元素非金属性越强,其最高价氧化物对应水化物酸性越强,非金属性:Cl>S>P,因此,酸性:HClO4>H2SO4>H3PO4;
C、元素非金属性越强,其气态氢化物稳定性越强,非金属性:Cl>Br>I,因此,稳定性:HCl>HBr>HI;
D、同一周期元素金属性从左到右递减,因此金属性:Al<Mg<Na.
B、元素非金属性越强,其最高价氧化物对应水化物酸性越强,非金属性:Cl>S>P,因此,酸性:HClO4>H2SO4>H3PO4;
C、元素非金属性越强,其气态氢化物稳定性越强,非金属性:Cl>Br>I,因此,稳定性:HCl>HBr>HI;
D、同一周期元素金属性从左到右递减,因此金属性:Al<Mg<Na.
解答:
解:A、同一周期元素原子半径从左到右逐渐减小,因此原子半径:C>N>O,故A错误;
B、元素非金属性越强,其最高价氧化物对应水化物酸性越强,非金属性:Cl>S>P,因此,酸性:HClO4>H2SO4>H3PO4,故B正确;
C、元素非金属性越强,其气态氢化物稳定性越强,非金属性:Cl>Br>I,因此,稳定性:HCl>HBr>HI,故C错误;
D、同一周期元素金属性从左到右递减,因此金属性:Al<Mg<Na,故D错误.
故选:B.
B、元素非金属性越强,其最高价氧化物对应水化物酸性越强,非金属性:Cl>S>P,因此,酸性:HClO4>H2SO4>H3PO4,故B正确;
C、元素非金属性越强,其气态氢化物稳定性越强,非金属性:Cl>Br>I,因此,稳定性:HCl>HBr>HI,故C错误;
D、同一周期元素金属性从左到右递减,因此金属性:Al<Mg<Na,故D错误.
故选:B.
点评:本题考查了元素周期律的有关知识,属于基础性题目,熟练掌握非金属性、金属性以及原子半径大小的判定是解题的关键.

练习册系列答案
相关题目
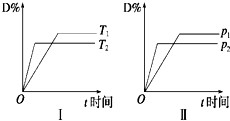 对于可逆反应mA(g)+nB(s)?pC(g)+qD(g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如图,下列说法正确的是( )
对于可逆反应mA(g)+nB(s)?pC(g)+qD(g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如图,下列说法正确的是( )| A、化学方程式中化学计量数:m>p+q |
| B、降温可使化学平衡向正反应方向移动 |
| C、使用合适的催化剂可使D%有所增加 |
| D、B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
苹果酸的结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A、苹果酸中能发生酯化反应的官能团有2种 |
| B、1mol苹果酸可与3mol NaOH发生中和反应 |
| C、1mol苹果酸与足量金属Na反应生成1mol H2 |
D、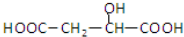 与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A、1mol FeI2与足量氯气反应时转移的电子数为2NA |
| B、2L 0.5mol?L-1硫酸钾溶液中阴离子所带电荷数为NA |
| C、1mol Na2O2固体中含离子总数为4NA |
| D、丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA |
 异秦皮啶具有镇静安神抗肿瘤功效,秦皮素具有抗痢疾杆菌功效.它们在一定条件下可发生转化,如图所示.有关说法正确的是( )
异秦皮啶具有镇静安神抗肿瘤功效,秦皮素具有抗痢疾杆菌功效.它们在一定条件下可发生转化,如图所示.有关说法正确的是( )| A、异秦皮啶与秦皮素互为同系物 |
| B、异秦皮啶转化为秦皮素的反应类型为取代反应 |
| C、秦皮素一定条件下能发生加成反应、消去反应和取代反应 |
| D、1mol秦皮素最多可与5molBr2、4molNaOH反应 |
提纯下列物质(括号内为要除去的杂质)的方法,正确的是( )
| A、金(沙子)--过滤 |
| B、NaCl(泥沙)--溶解、过滤、蒸发 |
| C、碘(水)--用酒精萃取 |
| D、NaCl(MgCl2)--加硫酸钠、过滤 |
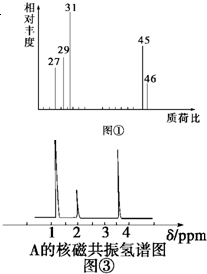 为测定某有机化合物A的结构,进行如下实验:
为测定某有机化合物A的结构,进行如下实验: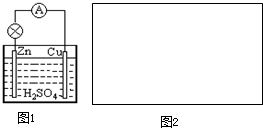 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.