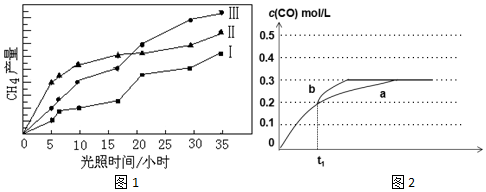
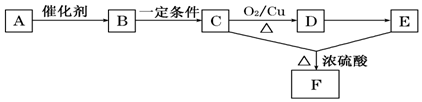
题目内容
2.下列关于元素性质的有关叙述中不正确的是( )| A. | S、Cl、O、F的原子半径依次减小 | |
| B. | Na、Mg、Al、Si的失电子能力依次增强 | |
| C. | C、N、O、F的气态氢化物的稳定性依次增强 | |
| D. | Si、P、S、Cl的最高价含氧酸的酸性依次增强 |
分析 A.电子层越多,原子半径越大,同周期从左向右原子半径减小;
B.同周期从左向右金属性减弱;
C.非金属性越强,对应氢化物越稳定;
D.非金属性越强,对应最高价含氧酸的酸性越强.
解答 解:A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则S、Cl、O、F的原子半径依次减小,故A正确;
B.同周期从左向右金属性减弱,则Na、Mg、Al、Si的失电子能力依次减小,故B错误;
C.非金属性越强,对应氢化物越稳定,则C、N、O、F的气态氢化物的稳定性依次增强,故C正确;
D.非金属性越强,对应最高价含氧酸的酸性越强,则Si、P、S、Cl的最高价含氧酸的酸性依次增强,故D正确;
故选B.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
13.X和Y均为短周期元素,X原子的最外层电子数是次外层电子数的2.5倍,Y原子是原子半径最小的原子,则X和Y形成的化合物的分子式可表示为( )
| A. | XY | B. | XY2 | C. | XY3 | D. | XY4 |
7.下列实验操作能达到目的是( )
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| B | 配制氯化铁溶液 | 将氯化铁溶解在较浓的盐酸中再加水稀释 |
| C | 确定Na2SO3样品是否部分被氧化 | 取样于试管中,加入稀硝酸酸化,再滴加BaCl2溶液,观察是否有白色沉淀生成 |
| D | 检验乙醇发生消去反应生成 乙烯 | 将生成的气体直接通入盛有酸性高锰酸钾溶液的试剂瓶,观察溶液是否褪色 |
| A. | A | B. | B | C. | C | D. | D |
11.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/L的Na2CO3溶液中:c(CO32-)═2c(HCO3-)+c(H+)-c(OH-) | |
| B. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) | |
| C. | 向3.0L0.1mol/LNaOH溶液中缓慢通入CO2至溶液增重8.8g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 等物质的量的CH3COOH、CH3COONa混合溶液PH=4.75中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
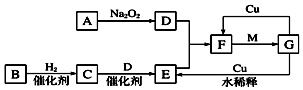
 .
.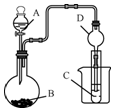 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.