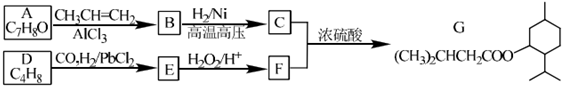
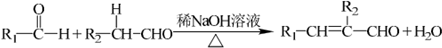
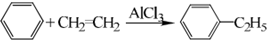题目内容
常温时,将V1mL、c1mol?L-1的氨水滴加到V2mL、c2mol?L-1的盐酸中,下述结论一定正确的是( )
| A、若c1=c2,混合液中c(NH4+)=c(Cl-),则V1>V2 |
| B、若混合溶液的pH=7,则c1V1<c2V2 |
| C、若V1≥V2,c1=c2,则混合液的pH>7 |
| D、若混合溶液的pH>7,则混合液中c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:A、根据当V1=V2时,氨水和盐酸恰好完全反应生成氯化铵来分析;
B、若混合溶液呈中性,由于氯化铵是强酸弱碱盐,则混合时碱稍微过量;
C、根据V1>V2或V1=V2来讨论分析;
D、混合溶液的pH>7时,可能是氨水适量过量或氨水大量过量.
B、若混合溶液呈中性,由于氯化铵是强酸弱碱盐,则混合时碱稍微过量;
C、根据V1>V2或V1=V2来讨论分析;
D、混合溶液的pH>7时,可能是氨水适量过量或氨水大量过量.
解答:
解:A、混合液中c(NH4+)=c(Cl-),可知C(H+)=C(OH-),溶液显中性,当V1=V2时,氨水和盐酸恰好完全反应生成氯化铵,溶液显酸性,故要想溶液显中性,故氨水必须过量,即V1>V2,故A正确;
B、若混合溶液呈中性,氯化铵是强酸弱碱盐,则混合时碱稍微过量,所以原溶液中c1V1>c2V2,故B错误;
C、由于c1=c2,当V1=V2时,氨水和盐酸的物质的量相等,两者恰好完全反应生成氯化铵,溶液显酸性,即pH<7;当V1稍大于V2时,溶液显中性,即pH=7;当V1大于V2时,氨水过量较多,溶液显碱性,即pH>7,故C错误;
D、当氨水适量过量时,溶液中的成分是浓度相近的氯化铵和氨水,此时溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+);当氨水大量过量时,溶液中是少量的氯化铵和大量的氨水,此时溶液中的离子浓度为:c(NH4+)>c(OH-)>c(Cl-)>c(H+),故D错误.
故选A.
B、若混合溶液呈中性,氯化铵是强酸弱碱盐,则混合时碱稍微过量,所以原溶液中c1V1>c2V2,故B错误;
C、由于c1=c2,当V1=V2时,氨水和盐酸的物质的量相等,两者恰好完全反应生成氯化铵,溶液显酸性,即pH<7;当V1稍大于V2时,溶液显中性,即pH=7;当V1大于V2时,氨水过量较多,溶液显碱性,即pH>7,故C错误;
D、当氨水适量过量时,溶液中的成分是浓度相近的氯化铵和氨水,此时溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+);当氨水大量过量时,溶液中是少量的氯化铵和大量的氨水,此时溶液中的离子浓度为:c(NH4+)>c(OH-)>c(Cl-)>c(H+),故D错误.
故选A.
点评:本题考查中和反应、盐类水解、pH值等知识,题目难度不大,注意一水合氨为弱电解质的性质,注意溶液电中性原则的利用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用足量的锌粒和一定量的稀硫酸反应制备H2,向该稀硫酸中加入下列溶液,能使反应的速度减慢,又不影响生成H2的总量(同温同压下),该溶液一定不可能为( )
| A、K2CO3 |
| B、BaCl2 |
| C、CH3COONa |
| D、Na2SO4 |
下列选项中粒子浓度关系不正确的是( )
| A、Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) |
| B、NaHCO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| C、pH=2的盐酸溶液与pH=12的氨水混合所得溶液中:cc(H+)+(NH4+)=c(OH-)+c(Cl-) |
| D、等物质的量的CH3COOH和CH3COONa溶液等体积混合所得溶液中:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) |
用下列所实验装置进行相应实验,能达到实验目的是( )


| A、用图Ⅰ所示装置吸收尾气中的二氧化碳 |
| B、用图Ⅱ所示装置配制100mL0.500mol?L-1稀硫酸 |
| C、用图Ⅲ所示装置除去溴苯中少量的溴 |
| D、用图Ⅳ所示装置进行已知浓度的氢氧化钠溶液测定盐酸浓度的实验 |
在2A+B?3C+4D反应中,下面表示的反应速率最快的是( )
| A、v(A)=3.0mol?L-1?min-1 |
| B、v(B)=2.0mol?L-1?min-1 |
| C、v(C)=4.8mol?L-1?min-1 |
| D、v(D)=1.0mol?L-1?min-1 |