题目内容
4.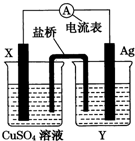 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池,如图所示.请回答下列问题.
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池,如图所示.请回答下列问题.(1)电极X的材料是铜(填名称);电解质溶液Y是AgNO3(填化学式).
(2)银电极上发生的电极反应式为Ag++e-=Ag;X电极上发生的电极反应式为Cu-2e-=Cu2+.
(3)外电路中的电流的流向是由Ag→X.( A.由X→Ag、B.由Ag→X)
分析 根据反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”分析,在反应中,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,电解质溶液为AgNO3 ,原电池中,电子从负极经外电路流向正极,由此分析解答.
解答 解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:铜;AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,
故答案为:Ag++e=Ag;Cu-2e-=Cu2+;
(3)原电池中,电子从负极经外电路流向正极,电流与电子流动方向相反,则由银流向X,
故答案为:由Ag→X.
点评 本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法性问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列物质间的反应不属于离子反应的是( )
| A. | CO+O2 | B. | NaCl+AgNO3 | C. | CaCO3+HCl | D. | CuO+H2 |
19.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 天然气、太阳能、生物质能、风能、氢能均属于新能源 | |
| C. | 自发反应的熵一定增大,非自发反应的熵一定减小 | |
| D. | 常温下,反应C(s)+CO2(g)?2CO(g)不能自发进行,则该反应的△H>0 |
9.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p1;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )
| A. | 第一电离能:③>②>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:③<②<① | D. | 最高正化合价:③>②>① |
16.氯气之所以长期用于自来水消毒,原因是( )
| A. | 氯气有毒,可以毒死细菌、病毒 | |
| B. | 氯气具有刺激性气味,可以熏死细菌、病毒 | |
| C. | 氯气与水反应生成具有强氧化性的HClO,可以杀死细菌、病毒 | |
| D. | 氯气是绿色气体,不会污染空气 |
13.下列事故或药品的处理正确的是( )
| A. | 少量浓硫酸溅到皮肤上,立即用氢氧化钠溶液冲洗 | |
| B. | 当出现CO中毒时,应立即将中毒者抬到室外空气新鲜处 | |
| C. | 将含硫酸的废液倒入水槽,用水冲入下水道 | |
| D. | 制取并收集氧气结束后,应立即停止加热 |
14.已知1.505×1023个A气体分子的质量为16g,则A气体的摩尔质量是( )
| A. | 64g/mol | B. | 32g/mol | C. | 32g | D. | 16g |
