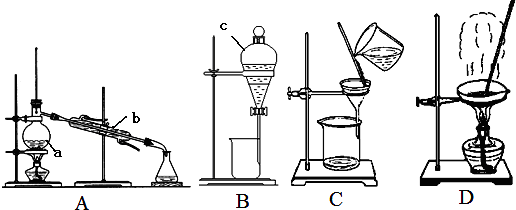
题目内容
9.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p1;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )| A. | 第一电离能:③>②>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:③<②<① | D. | 最高正化合价:③>②>① |
分析 ①1s22s22p63s23p1基态原子的电子排布式是Al;②1s22s22p63s23p3基态原子的电子排布式是 P;③1s22s22p5基态原子的电子排布式是F,由此分析解答.
解答 解:A、非金属的第一电离能大于金属,而且非金属性越强,第一电离能越大,所以第一电离能:③>②>①,故A正确;
B、电子层数越多半径越大,电子层数相同时核电荷数越多半径越小,所以原子半径:①>②>③,故B错误;
C、非金属性越强电负性越大,所以电负性:③>②>①,故C错误;
D、氟的非金属性特强只显负价和和0价,没有正价,故D错误;
故选A.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生判断及元素周期律的灵活运用,正确判断元素、明确元素周期律内涵是解本题关键,注意第一电离能规律中的反常现象,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa):
①C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2 878kJ•mol-1
②C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2 658kJ•mol-1
③C4H10(g)+$\frac{9}{2}$O2(g)═4CO(g)+5H2O(l)△H=-1 746kJ•mol-1
④C4H10(g)+$\frac{9}{2}$O2(g)═4CO(g)+5H2O(g)△H=-1 526kJ•mol-1
由此判断,正丁烷的燃烧热是 ( )
①C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2 878kJ•mol-1
②C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2 658kJ•mol-1
③C4H10(g)+$\frac{9}{2}$O2(g)═4CO(g)+5H2O(l)△H=-1 746kJ•mol-1
④C4H10(g)+$\frac{9}{2}$O2(g)═4CO(g)+5H2O(g)△H=-1 526kJ•mol-1
由此判断,正丁烷的燃烧热是 ( )
| A. | △H=-2 878 kJ•mol-1 | B. | △H=-2 658 kJ•mol-1 | ||
| C. | △H=-1 746 kJ•mol-1 | D. | △H=-1 526 kJ•mol-1 |
17.两种气态烃的混合物共0.1mol,完全燃烧后得到3.36L CO2(标准状况)和3.6g H2O,下列说法正确的是( )
| A. | 一定有乙烯 | B. | 一定有甲烷 | ||
| C. | 一定没有乙烯 | D. | 可能是甲烷和丁烯的混合物 |
14.化学与人类生活、社会可持续发展密切相关.下列措施有利于节能减排、保护环境的是:( )
①研发易降解的生物农药; ②加快化石燃料的开采与使用;③田间焚烧秸秆; ④应用高效洁净的能源转化技术; ⑤推广使用节能环保材料.
①研发易降解的生物农药; ②加快化石燃料的开采与使用;③田间焚烧秸秆; ④应用高效洁净的能源转化技术; ⑤推广使用节能环保材料.
| A. | ①④⑤ | B. | ②④⑤ | C. | ①②④ | D. | ②③⑤ |
1.下列叙述中正确的是( )
| A. | 相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等 | |
| B. | 标准状况下,28 g CO和22.4 L H2O所含分子数相等 | |
| C. | 5.6 g铁粉与足量盐酸充分反应,有0.2 mol电子转移 | |
| D. | 等质量的CH4和NH3所含电子数相等 |
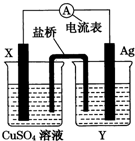 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池,如图所示.请回答下列问题.
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池,如图所示.请回答下列问题.